European Journal of Medicinal Chemistry ( IF 6.0 ) Pub Date : 2018-05-08 , DOI: 10.1016/j.ejmech.2018.05.012 David Pulido , Guillem Prats-Ejarque , Clara Villalba , Marcel Albacar , Mohammed Moussaoui , David Andreu , Rudolf Volkmer , Marc Torrent , Ester Boix
|
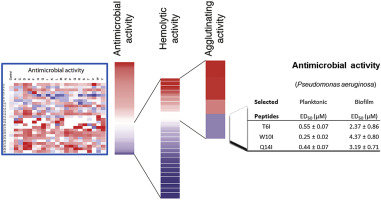
Eradication of established biofilm communities of pathogenic bacteria is one of the pending challenges in the development of new antimicrobial agents. In particular, the dreaded nosocomial Pseudomonas aeruginosa forms microbial communities that offer an enhanced resistance to conventional antibiotics. Recently, we have described an engineered antimicrobial peptide derived from the human RNase3, also named the eosinophil cationic protein (ECP), RN3 (5–36), which combines bactericidal activity with high cell agglutination and lipopolysaccharide (LPS) affinity. Through a single replacement scan library using the SPOT methodology we have evaluated both the contribution of sequence positioning and amino acid singularity towards the peptide biological and physicochemical properties. Results indicate that the ECP N-terminus has already been extensively improved through evolution to provide high antimicrobial activity; hence most substitutions improving its antimicrobial performance are in detriment of safety towards host tissues. Only three positions were identified, occupied by polar residues on the first α-helix of the protein and replaceable by a hydrophobic residue, allowing an extended N-terminal patch that mediates bacterial agglutination. Among the best candidates, an Ile replacement proved best in improving the peptide therapeutic window. The novel engineered peptides encompass both the LPS-binding and aggregation-prone regions of parental ECP, providing the appropriate structural features for peptide attachment to the bacterial exopolysaccharide layer and bacterial cell membrane destabilization, thereby promoting biofilm removal at micro molar concentrations. We conclude that the novel engineered peptides are promising lead candidates against Gram-negative biofilms.
中文翻译:

应用于人类嗜酸性粒细胞阳离子蛋白/ RNase3 N末端的位置扫描文库揭示了新型有效的抗生物膜肽
消灭已建立的病原性细菌生物膜群落是新的抗菌剂开发中的未决挑战之一。特别是可怕的医院铜绿假单胞菌形成对传统抗生素具有增强抵抗力的微生物群落。最近,我们描述了一种源自人RNase3的工程化抗菌肽,也称为嗜酸性粒细胞阳离子蛋白(ECP)RN3(5-36),该肽结合了具有高细胞凝集和脂多糖(LPS)亲和力的杀菌活性。通过使用SPOT方法的单个替换扫描库,我们评估了序列定位和氨基酸奇异性对肽生物学和理化性质的贡献。结果表明,ECP N末端已经通过进化得到了广泛改进,以提供高抗菌活性。因此,大多数改善其抗菌性能的替代品损害了对宿主组织的安全性。仅鉴定出三个位置,被蛋白质的第一个α-螺旋上的极性残基占据,并且可以被疏水性残基取代,从而获得了介导细菌凝集的扩展的N-末端斑块。在最好的候选药物中,Ile替代品在改善肽治疗窗口方面被证明是最好的。新型工程改造的肽涵盖了亲本ECP的LPS结合区域和易于聚集的区域,为肽附着到细菌胞外多糖层和细菌细胞膜失稳提供了适当的结构特征,从而在微摩尔浓度下促进了生物膜的去除。我们得出的结论是,新型工程化肽是有望对抗革兰氏阴性生物膜的潜在候选药物。被蛋白质的第一个α-螺旋上的极性残基占据并可以被疏水性残基取代,从而形成介导细菌凝集的扩展N末端斑块。在最好的候选药物中,Ile替代品在改善肽治疗窗口方面被证明是最好的。新型工程改造的肽涵盖了亲本ECP的LPS结合区域和易于聚集的区域,为肽附着到细菌胞外多糖层和细菌细胞膜失稳提供了适当的结构特征,从而在微摩尔浓度下促进了生物膜的去除。我们得出的结论是,新型工程化肽是有望对抗革兰氏阴性生物膜的潜在候选药物。被蛋白质的第一个α-螺旋上的极性残基占据并可以被疏水性残基取代,从而形成介导细菌凝集的扩展N末端斑块。在最佳候选药物中,Ile替代品在改善肽治疗窗口方面被证明是最佳的。新型工程改造的肽涵盖了亲本ECP的LPS结合区域和易于聚集的区域,为肽附着到细菌胞外多糖层和细菌细胞膜失稳提供了适当的结构特征,从而在微摩尔浓度下促进了生物膜的去除。我们得出的结论是,新型工程化肽是有望对抗革兰氏阴性生物膜的潜在候选药物。事实证明,Ile替代品可改善肽治疗范围,效果最佳。新型工程改造的肽涵盖了亲本ECP的LPS结合区域和易于聚集的区域,为肽附着到细菌胞外多糖层和细菌细胞膜失稳提供了适当的结构特征,从而在微摩尔浓度下促进了生物膜的去除。我们得出的结论是,新型工程化肽是有望对抗革兰氏阴性生物膜的潜在候选药物。事实证明,Ile替代品可改善肽治疗范围,效果最佳。新型工程改造的肽涵盖了亲本ECP的LPS结合区域和易于聚集的区域,为肽附着到细菌胞外多糖层和细菌细胞膜失稳提供了适当的结构特征,从而在微摩尔浓度下促进了生物膜的去除。我们得出的结论是,新型工程化肽是有望对抗革兰氏阴性生物膜的潜在候选药物。从而在微摩尔浓度下促进生物膜的去除。我们得出的结论是,新型工程化肽是有望对抗革兰氏阴性生物膜的潜在候选药物。从而在微摩尔浓度下促进生物膜的去除。我们得出的结论是,新型工程化肽是有望对抗革兰氏阴性生物膜的潜在候选药物。











































 京公网安备 11010802027423号
京公网安备 11010802027423号