当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Insights into the Active Site of Coproheme Decarboxylase from Listeria monocytogenes.
Biochemistry ( IF 2.9 ) Pub Date : 2018-03-22 , DOI: 10.1021/acs.biochem.8b00186 Lisa Milazzo 1 , Stefan Hofbauer 2 , Barry D Howes 1 , Thomas Gabler 2 , Paul G Furtmüller 2 , Christian Obinger 2 , Giulietta Smulevich 1
Biochemistry ( IF 2.9 ) Pub Date : 2018-03-22 , DOI: 10.1021/acs.biochem.8b00186 Lisa Milazzo 1 , Stefan Hofbauer 2 , Barry D Howes 1 , Thomas Gabler 2 , Paul G Furtmüller 2 , Christian Obinger 2 , Giulietta Smulevich 1
Affiliation
|
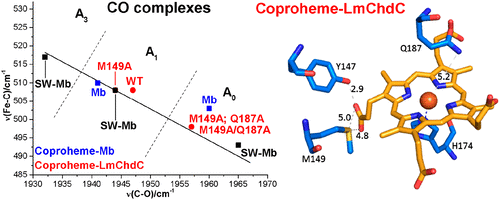
Coproheme decarboxylases (ChdC) catalyze the hydrogen peroxide-mediated conversion of coproheme to heme b. This work compares the structure and function of wild-type (WT) coproheme decarboxylase from Listeria monocytogenes and its M149A, Q187A, and M149A/Q187A mutants. The UV-vis, resonance Raman, and electron paramagnetic resonance spectroscopies clearly show that the ferric form of the WT protein is a pentacoordinate quantum mechanically mixed-spin state, which is very unusual in biological systems. Exchange of the Met149 residue to Ala dramatically alters the heme coordination, which becomes a 6-coordinate low spin species with the amide nitrogen atom of the Q187 residue bound to the heme iron. The interaction between M149 and propionyl 2 is found to play an important role in keeping the Q187 residue correctly positioned for closure of the distal cavity. This is confirmed by the observation that in the M149A variant two CO conformers are present corresponding to open (A0) and closed (A1) conformations. The CO of the latter species, the only conformer observed in the WT protein, is H-bonded to Q187. In the absence of the Q187 residue or in the adducts of all the heme b forms of ChdC investigated herein (containing vinyls in positions 2 and 4), only the A0 conformer has been found. Moreover, M149 is shown to be involved in the formation of a covalent bond with a vinyl substituent of heme b at excess of hydrogen peroxide.
中文翻译:

深入了解单核细胞增生李斯特菌中粪血红素脱羧酶的活性位点。
粪血红素脱羧酶 (ChdC) 催化过氧化氢介导的粪血红素转化为血红素 b。这项工作比较了单核细胞增生李斯特菌的野生型 (WT) 粪血红素脱羧酶及其 M149A、Q187A 和 M149A/Q187A 突变体的结构和功能。紫外可见、共振拉曼和电子顺磁共振光谱清楚地表明,WT 蛋白的铁形式是五配位量子力学混合自旋态,这在生物系统中是非常不寻常的。Met149 残基与 Ala 的交换显着改变了血红素配位,它变成了一个 6 配位的低自旋物质,Q187 残基的酰胺氮原子与血红素铁结合。发现 M149 和丙酰 2 之间的相互作用在保持 Q187 残基正确定位以闭合远端空腔方面发挥重要作用。观察结果证实了这一点,即在 M149A 变体中存在两个对应于开放 (A0) 和封闭 (A1) 构象的 CO 构象。后一种物种的 CO 是在 WT 蛋白中观察到的唯一构象异构体,与 Q187 是 H 键合的。在没有 Q187 残基或在本文研究的所有血红素 b 形式的 ChdC 的加合物中(在位置 2 和 4 中含有乙烯基),仅发现了 A0 构象异构体。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。观察结果证实了这一点,即在 M149A 变体中存在两个对应于开放 (A0) 和封闭 (A1) 构象的 CO 构象。后一种物种的 CO 是在 WT 蛋白中观察到的唯一构象异构体,与 Q187 是 H 键合的。在没有 Q187 残基或在本文研究的所有血红素 b 形式的 ChdC 的加合物中(在位置 2 和 4 中含有乙烯基),仅发现了 A0 构象异构体。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。观察结果证实了这一点,即在 M149A 变体中存在两个对应于开放 (A0) 和封闭 (A1) 构象的 CO 构象。后一种物种的 CO 是在 WT 蛋白中观察到的唯一构象异构体,与 Q187 是 H 键合的。在没有 Q187 残基或在本文研究的所有血红素 b 形式的 ChdC 的加合物中(在位置 2 和 4 中含有乙烯基),仅发现了 A0 构象异构体。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。只找到了 A0 构象。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。只找到了 A0 构象。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。
更新日期:2018-03-14
中文翻译:

深入了解单核细胞增生李斯特菌中粪血红素脱羧酶的活性位点。
粪血红素脱羧酶 (ChdC) 催化过氧化氢介导的粪血红素转化为血红素 b。这项工作比较了单核细胞增生李斯特菌的野生型 (WT) 粪血红素脱羧酶及其 M149A、Q187A 和 M149A/Q187A 突变体的结构和功能。紫外可见、共振拉曼和电子顺磁共振光谱清楚地表明,WT 蛋白的铁形式是五配位量子力学混合自旋态,这在生物系统中是非常不寻常的。Met149 残基与 Ala 的交换显着改变了血红素配位,它变成了一个 6 配位的低自旋物质,Q187 残基的酰胺氮原子与血红素铁结合。发现 M149 和丙酰 2 之间的相互作用在保持 Q187 残基正确定位以闭合远端空腔方面发挥重要作用。观察结果证实了这一点,即在 M149A 变体中存在两个对应于开放 (A0) 和封闭 (A1) 构象的 CO 构象。后一种物种的 CO 是在 WT 蛋白中观察到的唯一构象异构体,与 Q187 是 H 键合的。在没有 Q187 残基或在本文研究的所有血红素 b 形式的 ChdC 的加合物中(在位置 2 和 4 中含有乙烯基),仅发现了 A0 构象异构体。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。观察结果证实了这一点,即在 M149A 变体中存在两个对应于开放 (A0) 和封闭 (A1) 构象的 CO 构象。后一种物种的 CO 是在 WT 蛋白中观察到的唯一构象异构体,与 Q187 是 H 键合的。在没有 Q187 残基或在本文研究的所有血红素 b 形式的 ChdC 的加合物中(在位置 2 和 4 中含有乙烯基),仅发现了 A0 构象异构体。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。观察结果证实了这一点,即在 M149A 变体中存在两个对应于开放 (A0) 和封闭 (A1) 构象的 CO 构象。后一种物种的 CO 是在 WT 蛋白中观察到的唯一构象异构体,与 Q187 是 H 键合的。在没有 Q187 残基或在本文研究的所有血红素 b 形式的 ChdC 的加合物中(在位置 2 和 4 中含有乙烯基),仅发现了 A0 构象异构体。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。只找到了 A0 构象。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。只找到了 A0 构象。此外,M149 显示参与在过量的过氧化氢下与血红素 b 的乙烯基取代基形成共价键。











































 京公网安备 11010802027423号
京公网安备 11010802027423号