当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Folding-Degradation Relationship of a Membrane Protein Mediated by the Universally Conserved ATP-dependent Protease FtsH
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2018-03-12 , DOI: 10.1021/jacs.8b00832 Yiqing Yang , Ruiqiong Guo , Kristen Gaffney , Miyeon Kim , Shaima Muhammednazaar , Wei Tian 1 , Boshen Wang 1 , Jie Liang 1 , Heedeok Hong
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2018-03-12 , DOI: 10.1021/jacs.8b00832 Yiqing Yang , Ruiqiong Guo , Kristen Gaffney , Miyeon Kim , Shaima Muhammednazaar , Wei Tian 1 , Boshen Wang 1 , Jie Liang 1 , Heedeok Hong
Affiliation
|
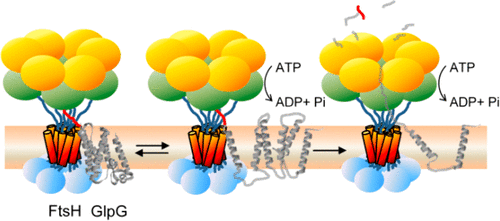
ATP-dependent protein degradation mediated by AAA+ proteases is one of the major cellular pathways for protein quality control and regulation of functional networks. While a majority of studies of protein degradation have focused on water-soluble proteins, it is not well understood how membrane proteins with abnormal conformation are selectively degraded. The knowledge gap stems from the lack of an in vitro system in which detailed molecular mechanisms can be studied as well as difficulties in studying membrane protein folding in lipid bilayers. To quantitatively define the folding-degradation relationship of membrane proteins, we reconstituted the degradation using the conserved membrane-integrated AAA+ protease FtsH as a model degradation machine and the stable helical-bundle membrane protein GlpG as a model substrate in the lipid bilayer environment. We demonstrate that FtsH possesses a substantial ability to actively unfold GlpG, and the degradation significantly depends on the stability and hydrophobicity near the degradation marker. We find that FtsH hydrolyzes 380-550 ATP molecules to degrade one copy of GlpG. Remarkably, FtsH overcomes the dual-energetic burden of substrate unfolding and membrane dislocation with the ATP cost comparable to that for water-soluble substrates by robust ClpAP/XP proteases. The physical principles elucidated in this study provide general insights into membrane protein degradation mediated by ATP-dependent proteolytic systems.
中文翻译:

普遍保守的 ATP 依赖性蛋白酶 FtsH 介导的膜蛋白的折叠降解关系
由 AAA+ 蛋白酶介导的 ATP 依赖性蛋白质降解是蛋白质质量控制和功能网络调节的主要细胞途径之一。虽然大多数蛋白质降解研究都集中在水溶性蛋白质上,但尚不清楚构象异常的膜蛋白如何被选择性降解。知识差距源于缺乏可以研究详细分子机制的体外系统,以及研究脂质双层中膜蛋白折叠的困难。为了定量定义膜蛋白的折叠降解关系,我们使用保守的膜整合 AAA+ 蛋白酶 FtsH 作为模型降解机,并使用稳定的螺旋束膜蛋白 GlpG 作为脂质双层环境中的模型底物,重建了降解过程。我们证明 FtsH 具有主动展开 GlpG 的强大能力,并且降解显着取决于降解标记物附近的稳定性和疏水性。我们发现 FtsH 水解 380-550 个 ATP 分子以降解一份 GlpG 拷贝。值得注意的是,FtsH 克服了底物展开和膜错位的双重能量负担,其 ATP 成本与强大的 ClpAP/XP 蛋白酶的水溶性底物相当。本研究阐明的物理原理为 ATP 依赖性蛋白水解系统介导的膜蛋白降解提供了一般见解。
更新日期:2018-03-12
中文翻译:

普遍保守的 ATP 依赖性蛋白酶 FtsH 介导的膜蛋白的折叠降解关系
由 AAA+ 蛋白酶介导的 ATP 依赖性蛋白质降解是蛋白质质量控制和功能网络调节的主要细胞途径之一。虽然大多数蛋白质降解研究都集中在水溶性蛋白质上,但尚不清楚构象异常的膜蛋白如何被选择性降解。知识差距源于缺乏可以研究详细分子机制的体外系统,以及研究脂质双层中膜蛋白折叠的困难。为了定量定义膜蛋白的折叠降解关系,我们使用保守的膜整合 AAA+ 蛋白酶 FtsH 作为模型降解机,并使用稳定的螺旋束膜蛋白 GlpG 作为脂质双层环境中的模型底物,重建了降解过程。我们证明 FtsH 具有主动展开 GlpG 的强大能力,并且降解显着取决于降解标记物附近的稳定性和疏水性。我们发现 FtsH 水解 380-550 个 ATP 分子以降解一份 GlpG 拷贝。值得注意的是,FtsH 克服了底物展开和膜错位的双重能量负担,其 ATP 成本与强大的 ClpAP/XP 蛋白酶的水溶性底物相当。本研究阐明的物理原理为 ATP 依赖性蛋白水解系统介导的膜蛋白降解提供了一般见解。











































 京公网安备 11010802027423号
京公网安备 11010802027423号