当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Rational-Differential Design of Highly Specific Glycomimetic Ligands: Targeting DC-SIGN and Excluding Langerin Recognition
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2017-12-22 00:00:00 , DOI: 10.1021/acschembio.7b00958 Vanessa Porkolab 1 , Eric Chabrol 1 , Norbert Varga 2 , Stefania Ordanini 2 , Ieva Sutkevičiu̅tė 1 , Michel Thépaut 1 , Maria José García-Jiménez 3 , Eric Girard 1 , Pedro M. Nieto 3 , Anna Bernardi 2 , Franck Fieschi 1
ACS Chemical Biology ( IF 3.5 ) Pub Date : 2017-12-22 00:00:00 , DOI: 10.1021/acschembio.7b00958 Vanessa Porkolab 1 , Eric Chabrol 1 , Norbert Varga 2 , Stefania Ordanini 2 , Ieva Sutkevičiu̅tė 1 , Michel Thépaut 1 , Maria José García-Jiménez 3 , Eric Girard 1 , Pedro M. Nieto 3 , Anna Bernardi 2 , Franck Fieschi 1
Affiliation
|
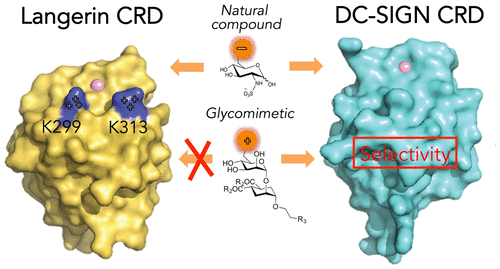
At the surface of dendritic cells, C-type lectin receptors (CLRs) allow the recognition of carbohydrate-based PAMPS or DAMPS (pathogen- or danger-associated molecular patterns, respectively) and promote immune response regulation. However, some CLRs are hijacked by viral and bacterial pathogens. Thus, the design of ligands able to target specifically one CLR, to either modulate an immune response or to inhibit a given infection mechanism, has great potential value in therapeutic design. A case study is the selective blocking of DC-SIGN, involved notably in HIV trans-infection of T lymphocytes, without interfering with langerin-mediated HIV clearance. This is a challenging task due to their overlapping carbohydrate specificity. Toward the rational design of DC-SIGN selective ligands, we performed a comparative affinity study between DC-SIGN and langerin with natural ligands. We found that GlcNAc is recognized by both CLRs; however, selective sulfation are shown to increase the selectivity in favor of langerin. With the combination of site-directed mutagenesis and X-ray structural analysis of the langerin/GlcNS6S complex, we highlighted that 6-sulfation of the carbohydrate ligand induced langerin specificity. Additionally, the K313 residue from langerin was identified as a critical feature of its binding site. Using a rational and a differential approach in the study of CLR binding sites, we designed, synthesized, and characterized a new glycomimetic, which is highly specific for DC-SIGN vs langerin. STD NMR, SPR, and ITC characterizations show that compound 7 conserved the overall binding mode of the natural disaccharide while possessing an improved affinity and a strict specificity for DC-SIGN
中文翻译:

高特异性拟糖配体的合理差分设计:靶向DC-SIGN,但不包括Langerin识别
在树突状细胞的表面,C型凝集素受体(CLR)允许识别基于碳水化合物的PAMPS或DAMPS(分别是与病原或危险相关的分子模式),并促进免疫应答调节。但是,某些CLR被病毒和细菌病原体劫持。因此,能够特异性靶向一种CLR以调节免疫应答或抑制给定感染机制的配体的设计在治疗设计中具有巨大的潜在价值。案例研究是选择性阻断DC-SIGN,特别是参与T淋巴细胞的HIV转染,而不会干扰Langerin介导的HIV清除。由于它们重叠的碳水化合物特异性,这是一项具有挑战性的任务。为了合理设计DC-SIGN选择性配体,我们在DC-SIGN和Langerin与天然配体之间进行了比较亲和力研究。我们发现,两个CLR均识别GlcNAc。然而,选择性硫酸盐化显示增加了对兰香素的选择性。结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 我们发现,两个CLR均识别GlcNAc。然而,选择性硫酸盐化显示增加了对兰香素的选择性。结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 我们发现,两个CLR均识别GlcNAc。然而,选择性硫酸盐化显示增加了对兰香素的选择性。结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物7保留了天然二糖的整体结合模式,同时具有改善的亲和力和对DC-SIGN的严格特异性
更新日期:2017-12-22
中文翻译:

高特异性拟糖配体的合理差分设计:靶向DC-SIGN,但不包括Langerin识别
在树突状细胞的表面,C型凝集素受体(CLR)允许识别基于碳水化合物的PAMPS或DAMPS(分别是与病原或危险相关的分子模式),并促进免疫应答调节。但是,某些CLR被病毒和细菌病原体劫持。因此,能够特异性靶向一种CLR以调节免疫应答或抑制给定感染机制的配体的设计在治疗设计中具有巨大的潜在价值。案例研究是选择性阻断DC-SIGN,特别是参与T淋巴细胞的HIV转染,而不会干扰Langerin介导的HIV清除。由于它们重叠的碳水化合物特异性,这是一项具有挑战性的任务。为了合理设计DC-SIGN选择性配体,我们在DC-SIGN和Langerin与天然配体之间进行了比较亲和力研究。我们发现,两个CLR均识别GlcNAc。然而,选择性硫酸盐化显示增加了对兰香素的选择性。结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 我们发现,两个CLR均识别GlcNAc。然而,选择性硫酸盐化显示增加了对兰香素的选择性。结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 我们发现,两个CLR均识别GlcNAc。然而,选择性硫酸盐化显示增加了对兰香素的选择性。结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 结合定点诱变和Langerin / GlcNS6S复合物的X射线结构分析,我们强调了碳水化合物配体的6-硫酸化诱导了Langerin特异性。另外,来自橘皮苷的K313残基被鉴定为其结合位点的关键特征。在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物 在研究CLR结合位点时,我们采用了合理且差异化的方法,设计,合成并表征了一种新的糖模拟物,该糖模拟物对DC-SIGN与langerin具有高度特异性。STD NMR,SPR和ITC表征表明该化合物7保留了天然二糖的整体结合模式,同时具有改善的亲和力和对DC-SIGN的严格特异性











































 京公网安备 11010802027423号
京公网安备 11010802027423号