当前位置:
X-MOL 学术
›
ACS Chem. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Direct Substrate Identification with an Analog Sensitive (AS) Viral Cyclin-Dependent Kinase (v-Cdk)
ACS Chemical Biology ( IF 4 ) Pub Date : 2017-12-19 00:00:00 , DOI: 10.1021/acschembio.7b00972 Angie C. Umaña 1 , Satoko Iwahori 1 , Robert F. Kalejta 1
ACS Chemical Biology ( IF 4 ) Pub Date : 2017-12-19 00:00:00 , DOI: 10.1021/acschembio.7b00972 Angie C. Umaña 1 , Satoko Iwahori 1 , Robert F. Kalejta 1
Affiliation
|
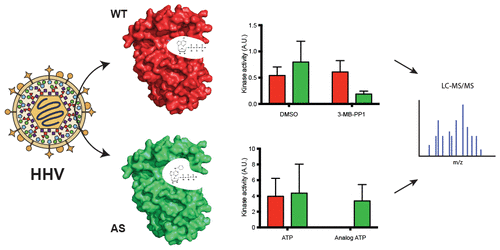
Viral cyclin-dependent kinases (v-Cdks) functionally emulate their cellular Cdk counterparts. Such viral mimicry is an established phenomenon that we extend here through chemical genetics. Kinases contain gatekeeper residues that limit the size of molecules that can be accommodated within the enzyme active site. Mutating gatekeeper residues to smaller amino acids allows larger molecules access to the active site. Such mutants can utilize bio-orthoganol ATPs for phosphate transfer and are inhibited by compounds ineffective against the wild type protein, and thus are referred to as analog-sensitive (AS) kinases. We identified the gatekeeper residues of the v-Cdks encoded by Epstein–Barr virus (EBV) and human cytomegalovirus (HCMV) and mutated them to generate AS kinases. The AS-v-Cdks are functional and utilize different ATP derivatives with a specificity closely matching their cellular ortholog, AS-Cdk2. The AS derivative of the EBV v-Cdk was used to transfer a thiolated phosphate group to targeted proteins which were then purified through covalent capture and identified by mass spectrometry. Pathway analysis of these newly identified direct substrates of the EBV v-Cdk extends the potential influence of this kinase into all stages of gene expression (transcription, splicing, mRNA export, and translation). Our work demonstrates the biochemical similarity of the cellular and viral Cdks, as well as the utility of AS v-Cdks for substrate identification to increase our understanding of both viral infections and Cdk biology.
中文翻译:

使用模拟敏感(AS)病毒细胞周期蛋白依赖性激酶(v-Cdk)进行直接底物鉴定
病毒细胞周期蛋白依赖性激酶(v-Cdks)在功能上模拟其细胞Cdk对应物。这种病毒的模仿是一种既定现象,我们通过化学遗传学将其延伸到这里。激酶包含关守残基,这些残基限制了可容纳在酶活性位点内的分子的大小。将看门者残基突变为较小的氨基酸可以使较大的分子进入活性位点。此类突变体可利用生物原糖醇ATP进行磷酸盐转移,并受到对野生型蛋白质无效的化合物的抑制,因此被称为类似物敏感(AS)激酶。我们鉴定了由爱泼斯坦-巴尔病毒(EBV)和人巨细胞病毒(HCMV)编码的v-Cdks的关守残基,并将其突变以产生AS激酶。AS-v-Cdks具有功能,并利用不同的ATP衍生物,其特异性与它们的细胞直系同源物AS-Cdk2紧密匹配。EBV v-Cdk的AS衍生物用于将硫醇化的磷酸基团转移至目标蛋白质,然后通过共价捕获进行纯化,并通过质谱鉴定。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。EBV v-Cdk的AS衍生物用于将硫醇化的磷酸基团转移至目标蛋白质,然后通过共价捕获进行纯化,并通过质谱鉴定。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。EBV v-Cdk的AS衍生物用于将硫醇化的磷酸基团转移至目标蛋白质,然后通过共价捕获进行纯化,并通过质谱鉴定。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。
更新日期:2017-12-19
中文翻译:

使用模拟敏感(AS)病毒细胞周期蛋白依赖性激酶(v-Cdk)进行直接底物鉴定
病毒细胞周期蛋白依赖性激酶(v-Cdks)在功能上模拟其细胞Cdk对应物。这种病毒的模仿是一种既定现象,我们通过化学遗传学将其延伸到这里。激酶包含关守残基,这些残基限制了可容纳在酶活性位点内的分子的大小。将看门者残基突变为较小的氨基酸可以使较大的分子进入活性位点。此类突变体可利用生物原糖醇ATP进行磷酸盐转移,并受到对野生型蛋白质无效的化合物的抑制,因此被称为类似物敏感(AS)激酶。我们鉴定了由爱泼斯坦-巴尔病毒(EBV)和人巨细胞病毒(HCMV)编码的v-Cdks的关守残基,并将其突变以产生AS激酶。AS-v-Cdks具有功能,并利用不同的ATP衍生物,其特异性与它们的细胞直系同源物AS-Cdk2紧密匹配。EBV v-Cdk的AS衍生物用于将硫醇化的磷酸基团转移至目标蛋白质,然后通过共价捕获进行纯化,并通过质谱鉴定。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。EBV v-Cdk的AS衍生物用于将硫醇化的磷酸基团转移至目标蛋白质,然后通过共价捕获进行纯化,并通过质谱鉴定。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。EBV v-Cdk的AS衍生物用于将硫醇化的磷酸基团转移至目标蛋白质,然后通过共价捕获进行纯化,并通过质谱鉴定。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。这些新发现的EBV v-Cdk直接底物的途径分析将这种激酶的潜在影响扩展到了基因表达的所有阶段(转录,剪接,mRNA输出和翻译)。我们的工作证明了细胞和病毒Cdks的生化相似性,以及AS v-Cdks用于底物鉴定的实用性,从而增加了我们对病毒感染和Cdk生物学的理解。



























 京公网安备 11010802027423号
京公网安备 11010802027423号