PLoS Pathogens ( IF 5.5 ) Pub Date : 2017-11-14 , DOI: 10.1371/journal.ppat.1006707 Yang Liu 1, 2 , Shenyuan Xu 3 , Andrew L Woodruff 3 , Ming Xia 2 , Ming Tan 2, 4 , Michael A Kennedy 3 , Xi Jiang 2, 4
|
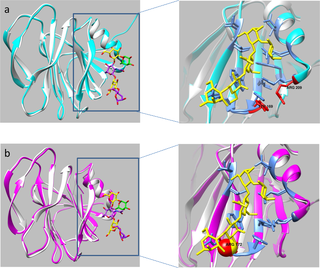
Recognition of specific cell surface glycans, mediated by the VP8* domain of the spike protein VP4, is the essential first step in rotavirus (RV) infection. Due to lack of direct structural information of virus-ligand interactions, the molecular basis of ligand-controlled host ranges of the major human RVs (P[8] and P[4]) in P[II] genogroup remains unknown. Here, through characterization of a minor P[II] RV (P[19]) that can infect both animals (pigs) and humans, we made an important advance to fill this knowledge gap by solving the crystal structures of the P[19] VP8* in complex with its ligands. Our data showed that P[19] RVs use a novel binding site that differs from the known ones of other genotypes/genogroups. This binding site is capable of interacting with two types of glycans, the mucin core and type 1 histo-blood group antigens (HBGAs) with a common GlcNAc as the central binding saccharide. The binding site is apparently shared by other P[II] RVs and possibly two genotypes (P[10] and P[12]) in P[I] as shown by their highly conserved GlcNAc-interacting residues. These data provide strong evidence of evolutionary connections among these human and animal RVs, pointing to a common ancestor in P[I] with a possible animal host origin. While the binding properties to GlcNAc-containing saccharides are maintained, changes in binding to additional residues, such as those in the polymorphic type 1 HBGAs may occur in the course of RV evolution, explaining the complex P[II] genogroup that mainly causes diseases in humans but also in some animals.
中文翻译:

P[19] VP8* 聚糖特异性的结构基础:对轮状病毒人畜共患病和进化的影响
识别由刺突蛋白 VP4 的 VP8* 结构域介导的特定细胞表面聚糖是轮状病毒 (RV) 感染必不可少的第一步。由于缺乏病毒-配体相互作用的直接结构信息,P[II] 基因组中主要人类 RV(P[8] 和 P[4])的配体控制宿主范围的分子基础仍然未知。在这里,通过对可以感染动物(猪)和人类的次要 P[II] RV(P[19])的表征,我们取得了重要进展,通过解决 P[19] 的晶体结构来填补这一知识空白VP8* 与其配体形成复合物。我们的数据显示 P[19] RVs 使用了一个新的结合位点,它不同于其他基因型/基因组的已知结合位点。这个结合位点能够与两种类型的聚糖相互作用,粘蛋白核心和 1 型组织血型抗原 (HBGA),以常见的 GlcNAc 作为中心结合糖。结合位点显然由其他 P[II] RV 和 P[I] 中可能的两种基因型(P[10] 和 P[12])共享,如其高度保守的 GlcNAc 相互作用残基所示。这些数据为这些人类和动物 RV 之间的进化联系提供了强有力的证据,表明 P[I] 中的一个共同祖先可能来自动物宿主。虽然保留了与含 GlcNAc 糖类的结合特性,但在 RV 进化过程中可能会发生与其他残基(例如多态性 1 型 HBGA 中的残基)结合的变化,这解释了主要导致疾病的复杂 P[II] 基因组人类,但也存在于某些动物中。结合位点显然由其他 P[II] RV 和 P[I] 中可能的两种基因型(P[10] 和 P[12])共享,如其高度保守的 GlcNAc 相互作用残基所示。这些数据为这些人类和动物 RV 之间的进化联系提供了强有力的证据,表明 P[I] 中的一个共同祖先可能来自动物宿主。虽然保留了与含 GlcNAc 糖类的结合特性,但在 RV 进化过程中可能会发生与其他残基(例如多态性 1 型 HBGA 中的残基)结合的变化,这解释了主要导致疾病的复杂 P[II] 基因组人类,但也存在于某些动物中。结合位点显然由其他 P[II] RV 和 P[I] 中可能的两种基因型(P[10] 和 P[12])共享,如其高度保守的 GlcNAc 相互作用残基所示。这些数据为这些人类和动物 RV 之间的进化联系提供了强有力的证据,表明 P[I] 中的一个共同祖先可能来自动物宿主。虽然保留了与含 GlcNAc 糖类的结合特性,但在 RV 进化过程中可能会发生与其他残基(例如多态性 1 型 HBGA 中的残基)结合的变化,这解释了主要导致疾病的复杂 P[II] 基因组人类,但也存在于某些动物中。这些数据为这些人类和动物 RV 之间的进化联系提供了强有力的证据,表明 P[I] 中的一个共同祖先可能来自动物宿主。虽然保留了与含 GlcNAc 糖类的结合特性,但在 RV 进化过程中可能会发生与其他残基(例如多态性 1 型 HBGA 中的残基)结合的变化,这解释了主要导致疾病的复杂 P[II] 基因组人类,但也存在于某些动物中。这些数据为这些人类和动物 RV 之间的进化联系提供了强有力的证据,表明 P[I] 中的一个共同祖先可能来自动物宿主。虽然保留了与含 GlcNAc 糖类的结合特性,但在 RV 进化过程中可能会发生与其他残基(例如多态性 1 型 HBGA 中的残基)结合的变化,这解释了主要导致疾病的复杂 P[II] 基因组人类,但也存在于某些动物中。











































 京公网安备 11010802027423号
京公网安备 11010802027423号