Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Extending roGFP Emission via Förster-Type Resonance Energy Transfer Relay Enables Simultaneous Dual Compartment Ratiometric Redox Imaging in Live Cells
ACS Sensors ( IF 8.2 ) Pub Date : 2017-11-07 00:00:00 , DOI: 10.1021/acssensors.7b00689 Stevie Norcross 1 , Keelan J. Trull 1 , Jordan Snaider 1 , Sara Doan 1 , Kiet Tat 1 , Libai Huang 1 , Mathew Tantama 1
ACS Sensors ( IF 8.2 ) Pub Date : 2017-11-07 00:00:00 , DOI: 10.1021/acssensors.7b00689 Stevie Norcross 1 , Keelan J. Trull 1 , Jordan Snaider 1 , Sara Doan 1 , Kiet Tat 1 , Libai Huang 1 , Mathew Tantama 1
Affiliation
|
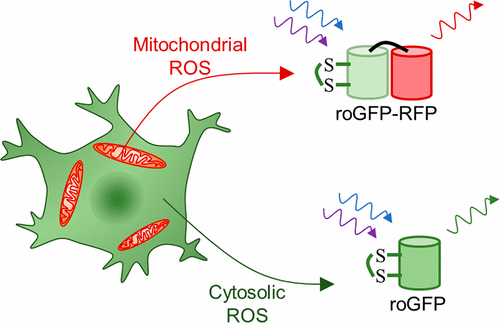
Reactive oxygen species (ROS) mediate both intercellular and intraorganellar signaling, and ROS propagate oxidative stress between cellular compartments such as mitochondria and the cytosol. Each cellular compartment contains its own sources of ROS as well as antioxidant mechanisms, which contribute to dynamic fluctuations in ROS levels that occur during signaling, metabolism, and stress. However, the coupling of redox dynamics between cellular compartments has not been well studied because of the lack of available sensors to simultaneously measure more than one subcellular compartment in the same cell. Currently, the redox-sensitive green fluorescent protein, roGFP, has been used extensively to study compartment-specific redox dynamics because it provides a quantitative ratiometric readout and it is amenable to subcellular targeting as a genetically encoded sensor. Here, we report a new family of genetically encoded fluorescent protein sensors that extend the fluorescence emission of roGFP via Förster-type resonance energy transfer to an acceptor red fluorescent protein for dual-color live-cell microscopy. We characterize the redox and optical properties of the sensor proteins, and we demonstrate that they can be used to simultaneously measure cytosolic and mitochondrial ROS in living cells. Furthermore, we use these sensors to reveal cell-to-cell heterogeneity in redox coupling between the cytosol and mitochondria when neuroblastoma cells are exposed to reductive and metabolic stresses.
中文翻译:

通过Förster型共振能量转移继电器扩展roGFP发射,可在活细胞中同时进行双室比率比例氧化还原成像
活性氧(ROS)介导细胞间和细胞内信号传导,并且ROS在细胞区室(例如线粒体和细胞质)之间传播氧化应激。每个细胞区室都有自己的ROS来源以及抗氧化剂机制,这些机制会导致信号传导,新陈代谢和应激过程中ROS水平的动态波动。但是,由于缺乏可用的传感器来同时测量同一细胞中一个以上的亚细胞室,因此尚未对细胞室之间的氧化还原动力学耦合进行很好的研究。目前,氧化还原敏感的绿色荧光蛋白roGFP,由于它提供定量的比率读数,并且适合作为遗传编码的传感器进行亚细胞靶向,因此已广泛用于研究特定于隔室的氧化还原动力学。在这里,我们报告了一个新的遗传编码荧光蛋白传感器家族,它通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。在这里,我们报告了一个新的遗传编码的荧光蛋白传感器家族,它通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。在这里,我们报告了一个新的遗传编码荧光蛋白传感器家族,它通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。我们报告了一个新的遗传编码的荧光蛋白传感器家族,该家族通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。我们报告了一个新的遗传编码的荧光蛋白传感器家族,该家族通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。
更新日期:2017-11-08
中文翻译:

通过Förster型共振能量转移继电器扩展roGFP发射,可在活细胞中同时进行双室比率比例氧化还原成像
活性氧(ROS)介导细胞间和细胞内信号传导,并且ROS在细胞区室(例如线粒体和细胞质)之间传播氧化应激。每个细胞区室都有自己的ROS来源以及抗氧化剂机制,这些机制会导致信号传导,新陈代谢和应激过程中ROS水平的动态波动。但是,由于缺乏可用的传感器来同时测量同一细胞中一个以上的亚细胞室,因此尚未对细胞室之间的氧化还原动力学耦合进行很好的研究。目前,氧化还原敏感的绿色荧光蛋白roGFP,由于它提供定量的比率读数,并且适合作为遗传编码的传感器进行亚细胞靶向,因此已广泛用于研究特定于隔室的氧化还原动力学。在这里,我们报告了一个新的遗传编码荧光蛋白传感器家族,它通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。在这里,我们报告了一个新的遗传编码的荧光蛋白传感器家族,它通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。在这里,我们报告了一个新的遗传编码荧光蛋白传感器家族,它通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。我们报告了一个新的遗传编码的荧光蛋白传感器家族,该家族通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。我们报告了一个新的遗传编码的荧光蛋白传感器家族,该家族通过Förster型共振能量转移将roGFP的荧光发射扩展到用于双色活细胞显微镜检查的红色受体荧光蛋白。我们表征传感器蛋白的氧化还原和光学性质,并且我们证明它们可以用于同时测量活细胞中的胞质和线粒体ROS。此外,当神经母细胞瘤细胞暴露于还原性和代谢性应激时,我们使用这些传感器来揭示细胞溶胶与线粒体之间氧化还原偶联中的细胞间异质性。











































 京公网安备 11010802027423号
京公网安备 11010802027423号