PLoS Pathogens ( IF 5.5 ) Pub Date : 2017-10-30 , DOI: 10.1371/journal.ppat.1006697 Benoit Besson , Florian Sonthonnax , Magalie Duchateau , Youcef Ben Khalifa , Florence Larrous , Hyeju Eun , Véronique Hourdel , Mariette Matondo , Julia Chamot-Rooke , Regis Grailhe , Hervé Bourhy
|
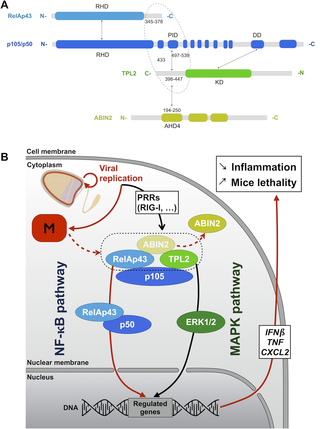
At the crossroad between the NF-κB and the MAPK pathways, the ternary complex composed of p105, ABIN2 and TPL2 is essential for the host cell response to pathogens. The matrix protein (M) of field isolates of rabies virus was previously shown to disturb the signaling induced by RelAp43, a NF-κB protein close to RelA/p65. Here, we investigated how the M protein disturbs the NF-κB pathway in a RelAp43-dependant manner and the potential involvement of the ternary complex in this mechanism. Using a tandem affinity purification coupled with mass spectrometry approach, we show that RelAp43 interacts with the p105-ABIN2-TPL2 complex and we observe a strong perturbation of this complex in presence of M protein. M protein interaction with RelAp43 is associated with a wide disturbance of NF-κB signaling, involving a modulation of IκBα-, IκBβ-, and IκBε-RelAp43 interaction and a favored interaction of RelAp43 with the non-canonical pathway (RelB and p100/p52). Monitoring the interactions between host and viral proteins using protein-fragment complementation assay and bioluminescent resonance energy transfer, we further show that RelAp43 is associated to the p105-ABIN2-TPL2 complex as RelAp43-p105 interaction stabilizes the formation of a complex with ABIN2 and TPL2. Interestingly, the M protein interacts not only with RelAp43 but also with TPL2 and ABIN2. Upon interaction with this complex, M protein promotes the release of ABIN2, which ultimately favors the production of RelAp43-p50 NF-κB dimers. The use of recombinant rabies viruses further indicates that this mechanism leads to the control of IFNβ, TNF and CXCL2 expression during the infection and a high pathogenicity profile in rabies virus infected mice. All together, our results demonstrate the important role of RelAp43 and M protein in the regulation of NF-κB signaling.
中文翻译:

p105-ABIN2-TPL2复合体和RelAp43在狂犬病毒感染过程中对NF-κB的调节
在NF-κB与MAPK途径之间的十字路口,由p105,ABIN2和TPL2组成的三元复合物对于宿主细胞对病原体的反应至关重要。狂犬病病毒野外分离株的基质蛋白(M)先前已显示出干扰RelAp43诱导的信号转导,RelAp43是一种接近RelA / p65的NF-κB蛋白。在这里,我们研究了M蛋白如何以RelAp43依赖性方式干扰NF-κB途径,以及三元复合物在该机制中的潜在参与。使用串联亲和纯化与质谱方法相结合,我们显示RelAp43与p105-ABIN2-TPL2复合物相互作用,并且在M蛋白存在的情况下我们观察到该复合物强烈干扰。M蛋白与RelAp43的相互作用与NF-κB信号传导的广泛干扰有关,涉及IκBα-,IκBβ-,和IκBε-RelAp43相互作用以及RelAp43与非典型途径的有利相互作用(RelB和p100 / p52)。使用蛋白片段互补测定和生物发光共振能量转移监测宿主和病毒蛋白之间的相互作用,我们进一步表明RelAp43与p105-ABIN2-TPL2复合物相关,因为RelAp43-p105相互作用稳定了与ABIN2和TPL2的复合物的形成。有趣的是,M蛋白不仅与RelAp43相互作用,而且与TPL2和ABIN2相互作用。与该复合物相互作用后,M蛋白促进ABIN2的释放,最终促进RelAp43-p50NF-κB二聚体的产生。重组狂犬病毒的使用进一步表明,这种机制导致了对狂犬病的控制。使用蛋白片段互补测定和生物发光共振能量转移监测宿主和病毒蛋白之间的相互作用,我们进一步表明RelAp43与p105-ABIN2-TPL2复合物相关,因为RelAp43-p105相互作用稳定了与ABIN2和TPL2的复合物的形成。有趣的是,M蛋白不仅与RelAp43相互作用,而且与TPL2和ABIN2相互作用。与该复合物相互作用后,M蛋白促进ABIN2的释放,最终促进RelAp43-p50NF-κB二聚体的产生。重组狂犬病毒的使用进一步表明,这种机制导致了对狂犬病的控制。使用蛋白片段互补测定和生物发光共振能量转移监测宿主和病毒蛋白之间的相互作用,我们进一步表明RelAp43与p105-ABIN2-TPL2复合物相关,因为RelAp43-p105相互作用稳定了与ABIN2和TPL2的复合物的形成。有趣的是,M蛋白不仅与RelAp43相互作用,而且与TPL2和ABIN2相互作用。与该复合物相互作用后,M蛋白促进ABIN2的释放,最终促进RelAp43-p50NF-κB二聚体的产生。重组狂犬病毒的使用进一步表明,这种机制导致了对狂犬病的控制。我们进一步表明,RelAp43与p105-ABIN2-TPL2复合物相关,因为RelAp43-p105相互作用可稳定与ABIN2和TPL2形成复合物。有趣的是,M蛋白不仅与RelAp43相互作用,而且与TPL2和ABIN2相互作用。与该复合物相互作用后,M蛋白促进ABIN2的释放,最终促进RelAp43-p50NF-κB二聚体的产生。重组狂犬病毒的使用进一步表明,这种机制导致了对狂犬病的控制。我们进一步表明,RelAp43与p105-ABIN2-TPL2复合物相关,因为RelAp43-p105相互作用可稳定与ABIN2和TPL2形成复合物。有趣的是,M蛋白不仅与RelAp43相互作用,而且与TPL2和ABIN2相互作用。与该复合物相互作用后,M蛋白促进ABIN2的释放,最终促进RelAp43-p50NF-κB二聚体的产生。重组狂犬病毒的使用进一步表明,这种机制导致了对狂犬病的控制。在狂犬病毒感染的小鼠中,感染期间IFNβ,TNF和CXCL2的表达以及高致病性。总之,我们的结果证明了RelAp43和M蛋白在调节NF-κB信号传导中的重要作用。











































 京公网安备 11010802027423号
京公网安备 11010802027423号