林文斌团队:光动力学敏化肿瘤环境,唤醒免疫卫士抗癌
利用刺激免疫系统来对抗肿瘤,是癌症研究中最热的领域之一。要想激活内源性抗肿瘤T细胞,一种方法就是阻断免疫细胞和其它白细胞表达的抑制受体,即免疫检查点阻断法,来重新激活肿瘤中的免疫作用,从而开启机体的天然屏障,杀死癌细胞。
细胞毒性T淋巴细胞抗原-4(CTLA-4)是第一个应用于临床的免疫检查点,其抑制剂ipilimumab,已在2011年被美国食品药品监督管理局批准用于治疗晚期黑色素瘤。此外,特异性结合T细胞表面程序性死亡受体-1(PD-1)的两种抗体类药物,nivolumab与pembrolizumab,也于2014年被批准用于肺癌及黑色素瘤的治疗。在2016年的5月,首个PD-L1抗体atezolizumab也获得FDA批准用于治疗晚期膀胱癌。
然而,基于免疫检查点阻断法的药物仅在20%至30%的患者中起作用。肿瘤周围被激活的T细胞过少,以及肿瘤表面抗原显示得不够多,是治疗失败的主要原因。

林文斌教授。图片来源:University of Chicago
一个看似无关紧要的现象引起了美国芝加哥大学林文斌(Wenbin Lin)教授(点击查看介绍)的关注:肿瘤患者在接受放射性治疗后,会有极少数情况下激活免疫系统,不仅能消除辐照的肿瘤,还能消除未接受辐照的转移瘤。研究人员认为,辐照处理有时会使T细胞暴露新抗原,引导它们靶向并杀死肿瘤细胞。基于此,林文斌教授做出如下猜想:是否可以借助于纳米粒子以同样的方式来激活免疫系统呢?
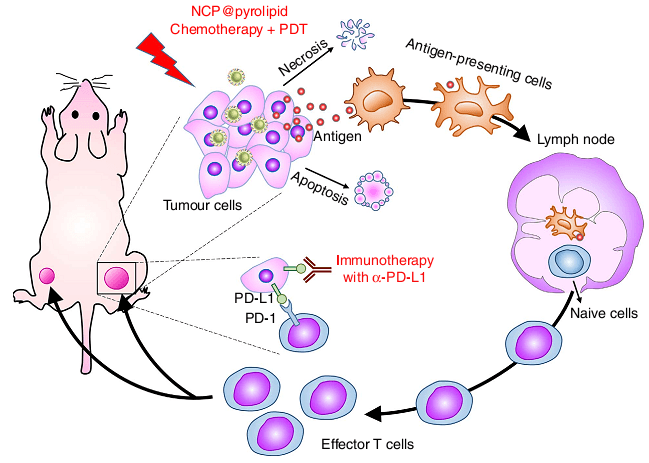
化学疗法与光动力学疗法增强检查点阻断免疫疗法。图片来源:Nat. Commun.
为此,他们采用纳米尺寸的配位聚合物形成的核壳结构的纳米粒子,同时负载抗癌药物奥沙利铂和光敏剂小分子,尝试着提高免疫检查点疗法对结肠癌的功效。一方面,抗癌药物奥沙利铂能引起免疫原性细胞死亡(Immunogenic cell death, ICD);另一方面,光敏剂小分子在光照下能够产生活性氧自由基,不仅能通过凋亡或坏死的方式杀死原位肿瘤,还能够刺激宿主免疫系统,产生急性炎症,使白细胞渗入肿瘤内,从而提高肿瘤相关抗原对T细胞的呈递。令研究人员感到惊喜的是,当这种纳米药剂与PD-L1检查点阻断疗法相结合时,不仅能消除原位的肿瘤,还能通过激活免疫系统来消除转移的肿瘤(Nat. Commun., 2016, DOI:10.1038/ncomms12499)。
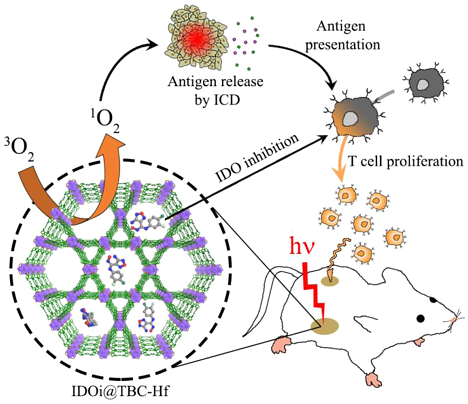
光动力学与免疫协同疗法。图片来源:JACS
在上述工作的基础上,他们进一步将光动力学治疗与免疫检查点阻断法融入到一个体系中。他们设计了一种装载有检查点抑制剂的纳米级金属有机框架(MOFs),对结肠癌进行治疗。这种金属有机框架结构中含二氢卟吩单元,可作为光敏剂在光照下产生活性氧自由基,产生免疫原性的细胞死亡,进而激活机体的免疫系统并促进抗原的呈递;另外,它所负载的检查点抑制剂可抑制吲哚胺2,3-双加氧酶的活性,改变免疫抑制的肿瘤环境。此外,两者的协同作用不仅可以杀死原位的肿瘤,还可以创造免疫原性微环境,防止肿瘤的转移(J. Am. Chem. Soc., 2016, 138, 12502-12510)。

光动力学敏化肿瘤环境用以增强免疫疗法。图片来源:JACS
为了进一步证实光动力学治疗能够通过增加肿瘤的免疫原性来提高免疫检查点阻断疗法的效果,他们选用了对目前免疫药物不敏感的乳腺癌作为研究对象。在该实验中,他们发现PD-L1抗体介导的免疫检查点阻断疗法对乳腺癌并未产生疗效,而将光动力学治疗与PD-L1抗体相结合,不仅能有效地消除原位肿瘤,还能防止肿瘤的转移并消除已转移的肿瘤。进一步研究表明,光动力学治疗在敏化肿瘤环境中起到两个方面的作用,一方面,光动力治疗产生免疫原性细胞死亡并释放出肿瘤相关抗原,呈递给T细胞产生肿瘤特异性效应T细胞;另一方面,光动力治疗还可以产生炎性环境,这可以增强效应T细胞以及其他免疫细胞渗入肿瘤的能力(J. Am. Chem. Soc., 2016, 138, 16686-16695)。
林文斌教授对这一系列的研究成果用于临床试验充满信心,他已经成立了名为Coordination Pharmaceuticals的公司,并已经募集到种子轮融资,有望在今年下半年进行早期的临床研究。
1. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Core-shell nanoscale coordination polymers combine chemotherapy and photodynamic therapy to potentiate checkpoint blockade cancer immunotherapy
Nat. Commun., 2016, 7, 12499, DOI: 10.1038/ncomms12499
2. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chlorin-Based Nanoscale Metal–Organic Framework Systemically Rejects Colorectal Cancers via Synergistic Photodynamic Therapy and Checkpoint Blockade Immunotherapy
J. Am. Chem. Soc., 2016, 138, 12502-12510, DOI: 10.1021/jacs.6b06663
3. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photodynamic Therapy Mediated by Nontoxic Core–Shell Nanoparticles Synergizes with Immune Checkpoint Blockade To Elicit Antitumor Immunity and Antimetastatic Effect on Breast Cancer
J. Am. Chem. Soc., 2016, 138, 16686-16695, DOI: 10.1021/jacs.6b09538
林文斌教授简介
http://www.x-mol.com/university/faculty/1445
部分内容编译自:
http://www.sciencemag.org/news/2017/01/nanoparticles-awaken-immune-cells-fight-cancer
(本文由冰供稿)
