《自然医学》双重磅:CRISPR曝重大漏洞!被成功编辑的细胞或缺失抑癌基因p53,具有潜在致癌能力
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
本周《自然医学》杂志上又发表了两篇与CRISPR技术相关的论文,暴露了尚未成熟的CRISPR/Cas9技术可能存在的一个关键缺陷!24小时之内,多家CRISPR基因编辑公司股价暴跌10%以上!
这两项研究分别来自瑞典卡洛林斯卡研究所[1]和剑桥诺华生物医学研究院[2],两个团队分别独立发现,CRISPR/Cas9基因编辑过程中造成的DNA双链断裂,实际上可以激活p53蛋白通路。该蛋白在基因修复过程中有关键作用,一定程度上导致了基因编辑的失败。这也意味着,基因编辑成功的细胞,往往具有p53缺陷——这也是癌细胞中最常见的基因突变!
换句话说,基因编辑成功的细胞很可能是潜在的癌细胞,利用CRISPR/Cas9进行临床治疗可能会无意中增加患癌症的风险!

CRISPR/Cas9可以说是发展得仿佛坐了火箭,这项技术首次走入人们眼帘还是在2012年,但是第一项临床试验去年就已经在中国进行了。技术走得太快,就必然存在一些尚未被发现的缺陷。
CRISPR/Cas9技术在应用过程中有个奇怪的现象,它在转化细胞(例如癌细胞)上编辑效率很高,副作用也很小;但是在治疗疾病方面具有极高潜能的人多能干细胞(hPSC)上,效率却咋也提不起来。与其他细胞类型相比,hPSC的基因修饰效率只有五到二十分之一[3-7]。
面对基因修饰,hPSC简直顽强到底,“宁死不从”[8-13]。
为了找出这其中的关键,剑桥诺华生物医学研究院研究者们开发了一种干细胞系,这种细胞在特定条件下表达Cas9蛋白,只需慢病毒转染gRNA就能实现插入特定基因序列。
这种方法的编辑效率很高,超过80%的细胞都转入了目标序列,但是更惨烈的是,绝大多数细胞都没能熬过这个过程,只有极少数的hPSC存活了下来。
CRISPR/Cas9过后,满地残留着细胞碎片,这个CRISPR/Cas9有毒啊……
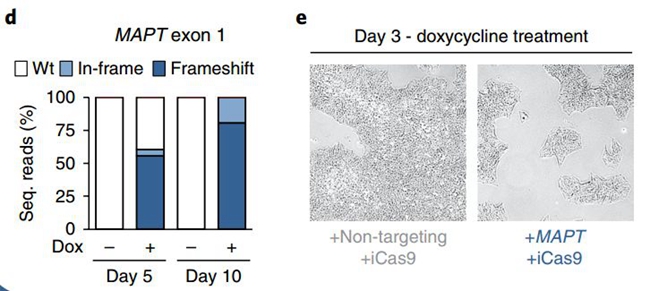
基因插入效率是很高,可是细胞也很受伤啊
研究者想到,是不是转入的gRNA种类太多,一次编辑好几个位点细胞受不了呢?以前也有研究显示编辑多个位点是对细胞损伤很大的。于是这次他们固定选择了一种不耽误细胞生存的基因,重复了上述实验,然而结果也是类似的。
对照组的细胞不涉及DNA链的断裂,就能好好生存好好扩增,而接受了基因插入的细胞真是惨烈极了,只有少部分尚能活蹦乱跳,大部分都没能熬过改造。
可见单个位点的DNA双链断裂,就足以对hPSC产生致死的毒性了!
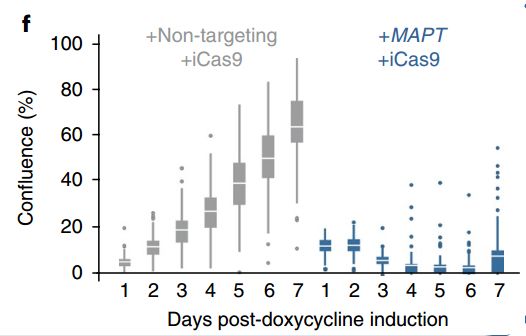
正常的细胞生长曲线和被“毒害”的细胞
为了探究这个过程中的关键分子通路,研究者们对表达变化较大的基因进行了筛选,最终发现最关键的人物竟然是我们都很熟悉的老朋友p53!进一步摸索,下游的通路则是与p21有关。确实,p53本身也在DNA损伤修复过程中起到了很大的作用[14],对能修复的损伤就修复,修复不了就让细胞自杀。
研究者尝试在细胞系中敲除p53基因,不出所料,p53缺陷的hPSC马上就对基因编辑表示驯服,不再拼死抵抗,生存率大大增加了。另一方面,在两个不同的干细胞系中,敲除p53使基因编辑的效率分别增加了19倍和16倍!
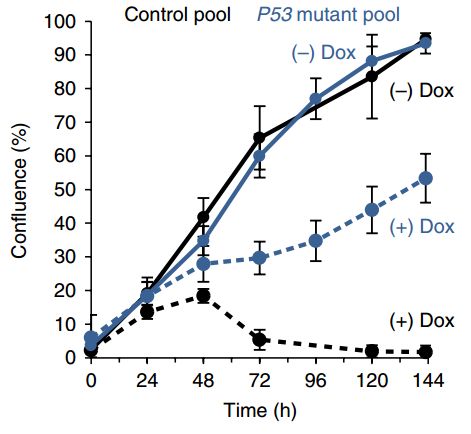
虽然还是有细胞顶不住压力,但是敲除了p53之后明显皮实多了
在另一项研究中,卡洛林斯卡研究所研究者在视网膜色素上皮(RPE)细胞中进行了类似的研究,同样发现CRISPR/Cas9基因编辑导致的DNA双链断裂会激活p53-p21通路,诱导细胞周期的停滞,导致基因编辑的失败。
除此之外,研究者还发现,在DNA双链被成功切断之后,Cas9蛋白还会在切断位点停留6个小时之久[18],这很可能耽误了正常的DNA损伤修复,加剧了DNA双链断裂带来的影响。
作者之一的Emma Happaniemi在采访中说,“挑选成功完成受损基因修复的细胞,我们很可能无意中挑选到p53缺陷的细胞。”“如果移植到患者体内,比如说在治疗遗传疾病的场景下,这些细胞很可能会引发癌症,导致人们对CRISPR基因治疗安全性的担忧。”[15]

这两篇论文一出,市场为之震动。目前已经走在临床前沿的CRISPR Therapeutics股价暴跌13%——这已经是上周被FDA叫停临床试验之后短期内第二次下跌了——其他基因编辑公司也受到了不小的影响,Editas Therapeutics、Intellia Therapeutics股价均有10%左右的下跌。[16]
CRISPR Therapeutics首席执行官Sam Kulkarni表示,该研究结果可信,虽然研究内容实际并不能覆盖所有的CRISPR使用情景。另一位因利益关系不愿透露姓名的科学家则表示十分担心,很多CRISPR导致的致命缺陷可能“已被错过”。[17]
看起来CRISPR/Cas9和p53之间的矛盾是不可调和的。要么p53不在,细胞有癌变风险;要么p53在,基因编辑失败和细胞自毁二选一。

但是这并不意味着CRISPR技术走进了死胡同。
卡洛林斯卡研究所的生化学家Bernhard Schmierer表示,这些都是十分早期的研究,只是“初步成果”,“目前还不清楚这些发现是否可以影响到临床实际使用的细胞。”此前在实验室中进行的研究,从未发现CRISPR导致的癌症,也一定程度上说明了问题。
而且研究关注点在于CRISPR/Cas9技术,在此之外,还有Cpf1等诸多颇具希望的Cas酶,这些酶是否会出现同样的p53困境还未可知。研究者也认为,如果只是剪除致病基因,而不涉及新基因的插入的话,p53是不会被“调动"的.
再说了,这个问题并不是完全没有办法解决。在现有的技术条件下,我们可以对编辑前后的细胞进行测序,监控p53功能,规避风险。
研究者们正在努力寻找p53通路的详细作用过程,如果可以在基因编辑过程中让p53暂时歇一歇,那岂不是美哉?而且在某些情况下,我们还有不需切断DNA的单碱基编辑技术,还是大有可为滴。
来自肯特大学的遗传学家Darren Griffin教授有句话说得很好,“几乎任何能够带来益处的治疗方法,都有能力造成伤害,这些发现应当被放在更大的背景中去思考。” [19]
技术前行总会遇到瓶颈,而每一次挫折都将使让我们更加强大。
参考资料:
[1] https://www.nature.com/articles/s41591-018-0049-z
[2] https://www.nature.com/articles/s41591-018-0050-6
[3]Mali, P. et al. RNA-guided human genome engineering via Cas9. Science 339,823–826 (2013).
[4]Hsu, P. D. et al. DNA targeting specifcity of RNA-guided Cas9 nucleases.Nat. Biotechnol. 31, 827–832 (2013).
[5]He, X. et al. Knock-in of large reporter genes in human cells via CRISPR/Cas9-induced homology-dependent and independent DNA repair. Nucleic Acids Res. 44, e85 (2016).
[6] Lombardo, A. et al. Gene editing in human stem cells using zinc fnger nucleases and integrase-defective lentiviral vector delivery. Nat. Biotechnol.25, 1298–1306 (2007).
[7]Lin, S., Staahl, B. T., Alla, R. K. & Doudna, J. A. Enhanced homologydirected human genome engineering by controlled timing of CRISPR/Cas9 delivery. Elife 3, e04766 (2014).
[8] Zwaka, T. P. & Tomson, J. A. Homologous recombination in human embryonic stem cells. Nat. Biotechnol. 21, 319–321 (2003).
[9] Hockemeyer, D. et al. Efcient targeting of expressed and silent genes in human ESCs and iPSCs using zinc-fnger nucleases. Nat. Biotechnol. 27,851–857 (2009).
[10]Liu, Y. & Rao, M. Gene targeting in human pluripotent stem cells. Methods Mol. Biol. 767, 355–367 (2011).
[11] Hockemeyer, D. & Jaenisch, R. Induced pluripotent stem cells meet genome editing. Cell Stem Cell 18, 573–586 (2016).
[12] Song, H., Chung, S. K. & Xu, Y. Modeling disease in human ESCs using an efcient BAC-based homologous recombination system. Cell Stem Cell 6,80–89 (2010).
[13] Merkle, F. T. et al. Efcient CRISPR-Cas9-mediated generation of knockin human pluripotent stem cells lacking undesired mutations at the targeted locus. Cell Rep. 11, 875–883 (2015).
[14] Lane, D. P. p53, Guardian of the genome. Nature 358, 15–16 (1992).
[15]https://ki.se/en/news/genome-editing-tool-could-increase-cancer-risk
[17]https://www.statnews.com/2018/06/11/crispr-hurdle-edited-cells-might-cause-cancer/
[18]Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L. & Corn, J. E. Nat.Biotechnol. 34, 339–344 (2016).
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号