PLoS Pathogens ( IF 5.5 ) Pub Date : 2017-09-22 , DOI: 10.1371/journal.ppat.1006607 Nayab Malik 1 , Abhay Kotecha 1 , Sarah Gold 2 , Amin Asfor 2 , Jingshan Ren 1 , Juha T Huiskonen 1, 3 , Tobias J Tuthill 2 , Elizabeth E Fry 1 , David I Stuart 1, 4
|
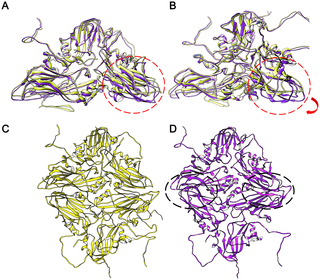
Foot-and-mouth disease virus (FMDV) belongs to the aphthovirus genus of the Picornaviridae, a family of small, icosahedral, non-enveloped, single-stranded RNA viruses. It is a highly infectious pathogen and is one of the biggest hindrances to the international trade of animals and animal products. FMDV capsids (which are unstable below pH6.5) release their genome into the host cell from an acidic compartment, such as that of an endosome, and in the process dissociate into pentamers. Whilst other members of the family (enteroviruses) have been visualized to form an expanded intermediate capsid with holes from which inner capsid proteins (VP4), N-termini (VP1) and RNA can be released, there has been no visualization of any such state for an aphthovirus, instead the capsid appears to simply dissociate into pentamers. Here we present the 8-Å resolution structure of isolated dissociated pentamers of FMDV, lacking VP4. We also found these pentamers to re-associate into a rigid, icosahedrally symmetric assembly, which enabled their structure to be solved at higher resolution (5.2 Å). In this assembly, the pentamers unexpectedly associate ‘inside out’, but still with their exposed hydrophobic edges buried. Stabilizing interactions occur between the HI loop of VP2 and its symmetry related partners at the icosahedral 3-fold axes, and between the BC and EF loops of VP3 with the VP2 βB-strand and the CD loop at the 2-fold axes. A relatively extensive but subtle structural rearrangement towards the periphery of the dissociated pentamer compared to that in the mature virus provides insight into the mechanism of dissociation of FMDV and the marked difference in antigenicity.
中文翻译:

口蹄疫病毒五聚体的结构:对衣壳解离和意外五聚体重组的洞察
口蹄疫病毒 (FMDV) 属于小核糖核酸病毒科口蹄疫病毒属,一个小型、二十面体、无包膜、单链 RNA 病毒家族。它是一种传染性很强的病原体,是动物和动物产品国际贸易的最大障碍之一。FMDV 衣壳(在 pH6.5 以下不稳定)将其基因组从酸性区室(例如内体区室)释放到宿主细胞中,并在此过程中解离成五聚体。虽然该家族的其他成员(肠道病毒)已被可视化形成一个带有孔的扩展中间衣壳,内部衣壳蛋白 (VP4)、N-末端 (VP1) 和 RNA 可以从中释放,但没有任何此类状态的可视化对于口疮病毒,衣壳似乎只是简单地解离成五聚体。在这里,我们展示了缺乏 VP4 的 FMDV 分离解离五聚体的 8-Å 分辨率结构。我们还发现这些五聚体重新结合成一个刚性的、二十面体对称的组装体,这使得它们的结构能够以更高分辨率 (5.2 Å) 解析。在这个组装中,五聚体出乎意料地“由内而外”地结合,但它们暴露的疏水边缘仍然被掩埋。稳定相互作用发生在 VP2 的 HI 环与其对称相关伙伴之间的二十面体 3 倍轴,以及 VP3 的 BC 和 EF 环与 VP2 βB 链和 CD 环之间的 2 倍轴。与成熟病毒相比,解离五聚体外围的相对广泛但微妙的结构重排提供了对 FMDV 解离机制和抗原性显着差异的洞察力。这使得它们的结构能够以更高分辨率 (5.2 Å) 解析。在这个组装中,五聚体出乎意料地“由内而外”地结合,但它们暴露的疏水边缘仍然被掩埋。稳定相互作用发生在 VP2 的 HI 环与其对称相关伙伴之间的二十面体 3 倍轴,以及 VP3 的 BC 和 EF 环与 VP2 βB 链和 CD 环之间的 2 倍轴。与成熟病毒相比,解离五聚体外围的相对广泛但微妙的结构重排提供了对 FMDV 解离机制和抗原性显着差异的洞察力。这使得它们的结构能够以更高分辨率 (5.2 Å) 解析。在这个组装中,五聚体出乎意料地“由内而外”地结合,但它们暴露的疏水边缘仍然被掩埋。稳定相互作用发生在 VP2 的 HI 环与其对称相关伙伴之间的二十面体 3 倍轴,以及 VP3 的 BC 和 EF 环与 VP2 βB 链和 CD 环之间的 2 倍轴。与成熟病毒相比,解离五聚体外围的相对广泛但微妙的结构重排提供了对 FMDV 解离机制和抗原性显着差异的洞察力。稳定相互作用发生在 VP2 的 HI 环与其对称相关伙伴之间的二十面体 3 倍轴,以及 VP3 的 BC 和 EF 环与 VP2 βB 链和 CD 环之间的 2 倍轴。与成熟病毒相比,解离五聚体外围的相对广泛但微妙的结构重排提供了对 FMDV 解离机制和抗原性显着差异的洞察力。稳定相互作用发生在 VP2 的 HI 环与其对称相关伙伴之间的二十面体 3 倍轴,以及 VP3 的 BC 和 EF 环与 VP2 βB 链和 CD 环之间的 2 倍轴。与成熟病毒相比,解离五聚体外围的相对广泛但微妙的结构重排提供了对 FMDV 解离机制和抗原性显着差异的洞察力。











































 京公网安备 11010802027423号
京公网安备 11010802027423号