当前位置:
X-MOL 学术
›
Adv. Funct. Mater.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Mutually Synergistic Nanoparticles for Effective Thermo‐Molecularly Targeted Therapy
Advanced Functional Materials ( IF 18.5 ) Pub Date : 2017-09-05 , DOI: 10.1002/adfm.201702834 Huanhuan Luo 1 , Qiaoli Wang 1 , Yibin Deng 1 , Tao Yang 1 , Hengte Ke 1 , Hong Yang 1 , Hui He 1 , Zhengqing Guo 2 , Dong Yu 2 , Hong Wu 3 , Huabing Chen 1, 2
Advanced Functional Materials ( IF 18.5 ) Pub Date : 2017-09-05 , DOI: 10.1002/adfm.201702834 Huanhuan Luo 1 , Qiaoli Wang 1 , Yibin Deng 1 , Tao Yang 1 , Hengte Ke 1 , Hong Yang 1 , Hui He 1 , Zhengqing Guo 2 , Dong Yu 2 , Hong Wu 3 , Huabing Chen 1, 2
Affiliation
|
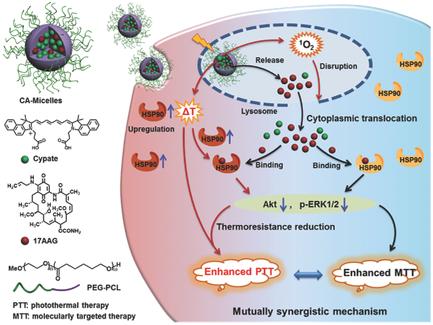
Photothermal therapy (PTT) is of particular importance as a highly potent therapeutic modality in cancer therapy. However, a critical challenge still remains in the exploration of highly effective strategy to maximize the PTT efficiency due to tumor thermoresistance and thus frequent tumor recurrence. Here, a rational fabrication of the micelles that can achieve mutual synergy of PTT and molecularly targeted therapy (MTT) for tumor ablation is reported. The micelles generate both distinct photothermal effect from Cypate through enhanced photothermal conversion efficiency and pH‐dependent drug release. The micelles further exhibit effective cytoplasmic translocation of 17‐allylamino‐17‐demethoxygeldanamycin (17AAG) through reactive oxygen species mediated lysosomal disruption caused by Cypate under irradiation. Translocated 17AAG specifically bind with heat shock protein 90 (HSP90), thereby inhibiting antiapoptotic p‐ERK1/2 proteins for producing preferable MTT efficiency through early apoptosis. Meanwhile, translocated 17AAG molecules further block stressfully overexpressed HSP90 under irradiation and thus inhibit the overexpression of p‐Akt for achieving the reduced thermoresistance of tumor cells, thus promoting the PTT efficiency through boosting both early and late apoptosis of Cypate. Moreover, the micelles possess enhanced resistance to photobleaching, preferable cellular uptake, and effective tumor accumulation, thus facilitating mutually synergistic PTT/MTT treatments with tumor ablation. These findings represent a general approach for potent cancer therapy.
中文翻译:

相互协同的纳米粒子,可进行有效的热分子靶向治疗
作为癌症治疗中的高效治疗手段,光热疗法(PTT)特别重要。然而,由于肿瘤的耐热性以及因此频繁的肿瘤复发,在探索最大化PTT效率的高效策略方面仍然存在关键挑战。在这里,报道了可以实现PTT与分子靶向治疗(MTT)相互消融的相互协同作用的胶束的合理制造。胶束通过增强的光热转化效率和pH依赖性药物释放,从Cypate产生独特的光热效应。胶束通过辐射下由Cypate引起的活性氧介导的溶酶体破坏,进一步表现出17-烯丙基氨基-17-去甲氧基格尔德霉素(17AAG)的有效胞质移位。易位的17AAG与热休克蛋白90(HSP90)特异性结合,从而抑制抗凋亡的p-ERK1 / 2蛋白,从而通过早期凋亡产生更好的MTT效率。同时,易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。从而抑制抗凋亡的p-ERK1 / 2蛋白,从而通过早期凋亡产生更好的MTT效率。同时,易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。从而抑制抗凋亡的p-ERK1 / 2蛋白,从而通过早期凋亡产生更好的MTT效率。同时,易位的17AAG分子在辐射下进一步阻断了压力过表达的HSP90,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT的效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT的效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。优选的细胞摄取和有效的肿瘤蓄积,从而促进与肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。优选的细胞摄取和有效的肿瘤蓄积,从而促进与肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。
更新日期:2017-09-05
中文翻译:

相互协同的纳米粒子,可进行有效的热分子靶向治疗
作为癌症治疗中的高效治疗手段,光热疗法(PTT)特别重要。然而,由于肿瘤的耐热性以及因此频繁的肿瘤复发,在探索最大化PTT效率的高效策略方面仍然存在关键挑战。在这里,报道了可以实现PTT与分子靶向治疗(MTT)相互消融的相互协同作用的胶束的合理制造。胶束通过增强的光热转化效率和pH依赖性药物释放,从Cypate产生独特的光热效应。胶束通过辐射下由Cypate引起的活性氧介导的溶酶体破坏,进一步表现出17-烯丙基氨基-17-去甲氧基格尔德霉素(17AAG)的有效胞质移位。易位的17AAG与热休克蛋白90(HSP90)特异性结合,从而抑制抗凋亡的p-ERK1 / 2蛋白,从而通过早期凋亡产生更好的MTT效率。同时,易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。从而抑制抗凋亡的p-ERK1 / 2蛋白,从而通过早期凋亡产生更好的MTT效率。同时,易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。从而抑制抗凋亡的p-ERK1 / 2蛋白,从而通过早期凋亡产生更好的MTT效率。同时,易位的17AAG分子在辐射下进一步阻断了压力过表达的HSP90,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT的效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。易位的17AAG分子在照射下进一步阻断了压力过高的HSP90的表达,从而抑制了p-Akt的过表达,从而降低了肿瘤细胞的耐热性,从而通过促进Cypate的早期和晚期凋亡来提高PTT的效率。而且,该胶束具有增强的对光漂白的抗性,优选的细胞摄取以及有效的肿瘤蓄积,因此促进了具有肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。优选的细胞摄取和有效的肿瘤蓄积,从而促进与肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。优选的细胞摄取和有效的肿瘤蓄积,从而促进与肿瘤消融的相互协同的PTT / MTT治疗。这些发现代表了有效的癌症治疗的一般方法。











































 京公网安备 11010802027423号
京公网安备 11010802027423号