当前位置:
X-MOL 学术
›
Cryst. Growth Des.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Lipidic Cubic Phase-Induced Membrane Protein Crystallization: Interplay Between Lipid Molecular Structure, Mesophase Structure and Properties, and Crystallogenesis
Crystal Growth & Design ( IF 3.2 ) Pub Date : 2017-08-29 00:00:00 , DOI: 10.1021/acs.cgd.7b00519 Alexandru Zabara 1, 2 , Thomas G. Meikle , Raphael Trenker 3 , Shenggen Yao , Janet Newman 2 , Thomas S. Peat 2 , Frances Separovic , Charlotte E. Conn 1 , Melissa J. Call 3 , Matthew E. Call 3 , Ehud M. Landau 4 , Calum J. Drummond 1
Crystal Growth & Design ( IF 3.2 ) Pub Date : 2017-08-29 00:00:00 , DOI: 10.1021/acs.cgd.7b00519 Alexandru Zabara 1, 2 , Thomas G. Meikle , Raphael Trenker 3 , Shenggen Yao , Janet Newman 2 , Thomas S. Peat 2 , Frances Separovic , Charlotte E. Conn 1 , Melissa J. Call 3 , Matthew E. Call 3 , Ehud M. Landau 4 , Calum J. Drummond 1
Affiliation
|
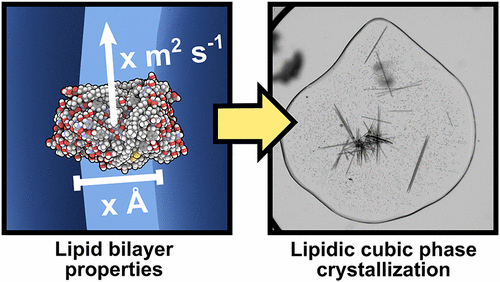
Obtaining well-diffracting crystals of membrane proteins, which is crucial to the molecular-level understanding of their intrinsic three-dimensional structure, dynamics, and function, represents a fundamental bottleneck in the field of structural biology. One of the major advances in the field of membrane protein structural determination was the realization that the nanostructured lipidic cubic phase (LCP) environment constitutes a membrane mimetic matrix that promotes solubilization, stabilization, and crystallization of specific membrane proteins. Despite two decades passing since the introduction of LCP-based membrane protein crystallization, the research community’s understanding of the processes that drive protein nucleation and macromolecular assembly in the LCP generally remains limited. In the current study, we present a detailed, systematic investigation into the relationship between the chemical structure of the lipid, the physical properties of the ensuing mesophase, the translational diffusion of the encapsulated membrane protein, and the resulting protein crystallization. Importantly, we show for the first time that cubic phase transport properties directly modulate the size and morphology of fully grown protein crystals without affecting their crystallographic space group. These findings provide a deeper understanding of the LCP-based crystal growth process, setting the stage for the engineering of membrane protein crystals at the molecular level via intentional design of the host cubic phase, and, ultimately, accelerating progress in the field of membrane protein structural biology.
中文翻译:

脂质立方相诱导的膜蛋白结晶:脂质分子结构,中间相结构和属性与结晶生成之间的相互作用。
获得膜蛋白的良好衍射晶体,这对于分子水平理解其固有的三维结构,动力学和功能至关重要,这代表了结构生物学领域的基本瓶颈。膜蛋白结构测定领域的主要进步之一是认识到纳米结构脂质立方相(LCP)环境构成了一种膜模拟基质,可促进特定膜蛋白的增溶,稳定和结晶。尽管自基于LCP的膜蛋白结晶引入以来已经过去了二十年,但研究界对LCP中驱动蛋白成核和大分子组装的过程的理解仍然十分有限。在当前的研究中,我们将详细介绍 系统地研究脂质的化学结构,随后的中间相的物理性质,所包封的膜蛋白的翻译扩散和所得蛋白结晶之间的关系。重要的是,我们首次证明了立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而不会影响其晶体学空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。随后中间相的物理性质,被包封的膜蛋白的翻译扩散以及所产生的蛋白结晶。重要的是,我们首次证明了立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而不会影响其晶体学空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。随后中间相的物理性质,被包封的膜蛋白的翻译扩散以及所产生的蛋白结晶。重要的是,我们首次证明了立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而不会影响其晶体学空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。我们首次表明,立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而没有影响其晶体空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。我们首次表明,立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而没有影响其晶体空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。
更新日期:2017-08-29
中文翻译:

脂质立方相诱导的膜蛋白结晶:脂质分子结构,中间相结构和属性与结晶生成之间的相互作用。
获得膜蛋白的良好衍射晶体,这对于分子水平理解其固有的三维结构,动力学和功能至关重要,这代表了结构生物学领域的基本瓶颈。膜蛋白结构测定领域的主要进步之一是认识到纳米结构脂质立方相(LCP)环境构成了一种膜模拟基质,可促进特定膜蛋白的增溶,稳定和结晶。尽管自基于LCP的膜蛋白结晶引入以来已经过去了二十年,但研究界对LCP中驱动蛋白成核和大分子组装的过程的理解仍然十分有限。在当前的研究中,我们将详细介绍 系统地研究脂质的化学结构,随后的中间相的物理性质,所包封的膜蛋白的翻译扩散和所得蛋白结晶之间的关系。重要的是,我们首次证明了立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而不会影响其晶体学空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。随后中间相的物理性质,被包封的膜蛋白的翻译扩散以及所产生的蛋白结晶。重要的是,我们首次证明了立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而不会影响其晶体学空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。随后中间相的物理性质,被包封的膜蛋白的翻译扩散以及所产生的蛋白结晶。重要的是,我们首次证明了立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而不会影响其晶体学空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。我们首次表明,立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而没有影响其晶体空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。我们首次表明,立方相传输特性直接调节了完全生长的蛋白质晶体的大小和形态,而没有影响其晶体空间群。这些发现提供了对基于LCP的晶体生长过程的更深入了解,通过对宿主立方相的有意设计为分子水平上的膜蛋白晶体工程化奠定了基础,并最终加速了膜蛋白领域的进展。结构生物学。











































 京公网安备 11010802027423号
京公网安备 11010802027423号