韩雯斐博士等揭示饱餐后愉悦感的神经环路
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
消化系统感受对于心理情绪的影响至关重要。美食可以是苦的、辣的,甚至可以有不悦的气味,但是食物带来的绝不仅是口舌的享受,更重要的是食物入腹后的满足感—消化后感受—这是产生美餐后愉悦情绪以及食物偏好的最重要原因。
9月20日,西奈山医学院Ivan De Araujo课题组(第一作者为韩雯斐博士,韩博士去年在Cell上发表封面论文报道了小鼠猎食行为的调控,详见BioArt此前的报道:Cell封面:小鼠猎食行为的调控)在Cell上发表题为A Neural Circuit for Gut-Induced Reward的最新研究,揭示消化系统与多巴胺系统之间的连接环路。

近端消化道,包括胃、十二指肠、近端结肠是营养吸收的主要部位。其黏膜下分布大量的肠内分泌神经元以及交感和副交感末梢神经。这些神经参与调节胃肠道的蠕动,各种激素的分泌,以及将食物中的营养信号直接发送至中枢系统。迷走神经的感觉神经元细胞体位于颈动脉附近的迷走神经节(Nodose Ganglion)内部,将诸多脏器的感觉信号输送到脑干。可是迷走神经节内的神经元几乎支配所有的内脏脏器,到底是哪一部分的神经元特异性地将胃肠道的消化信号发送到中枢呢?
为了解决组织分布特异性的问题,研究人员将逆突触传递的AAVretro-Cre病毒注入胃、十二指肠以及近端结肠的黏膜下(下图),等到携带Cre的病毒在迷走神经节内表达之后,再将Cre依赖的AAV-DIO-GFP注入迷走神经节内,从而特异性地观察支配胃肠道的迷走感觉神经元在孤束核内的支配范围。
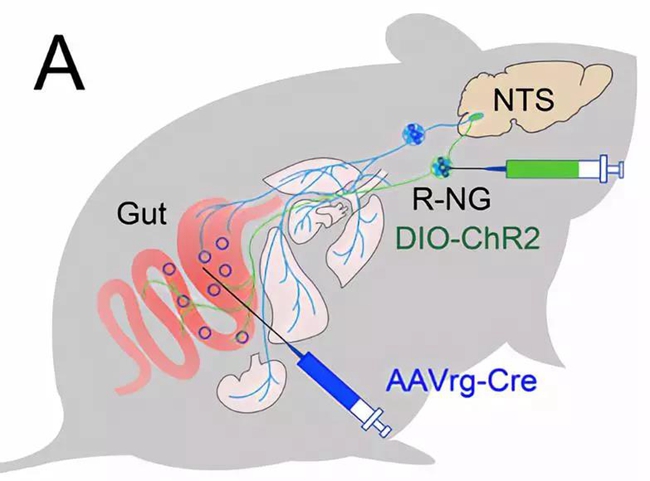
结果显示,上端肠胃的感觉信号只分布于较为中间偏后的孤束核区域。而且这一区域与分布心、肺、喉管等的感觉区域是完全分隔的(下图)。
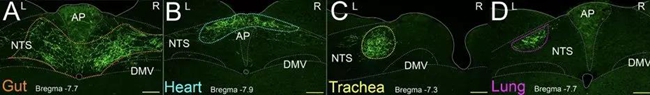
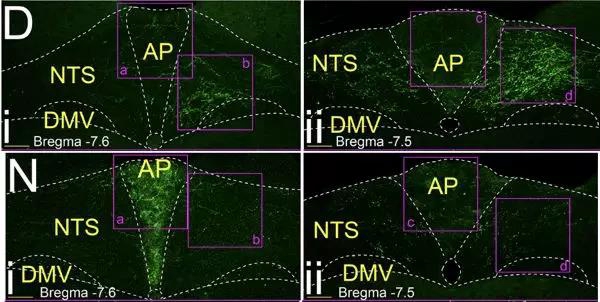
更有趣的是,同样是支配肠胃的迷走感觉神经元,左右两侧迷走神经节内的神经元在中枢的感觉支配也是不同的:右侧的中枢分布主要位于迷走神经孤束核NTS,而左侧主要分布于后极区AP(下图)。
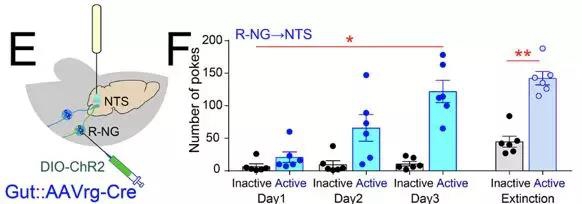
那么,左右两条迷走神经胃肠通路,到底哪一个是负责欣快感的呢?这个问题当然只有实验小鼠自己能回答。实验人员将光通道病毒表达在右侧迷走神经节内的胃肠支配神经内,然后将光纤放置在孤束核的支配区域上端。然后,训练小鼠自己用鼻触nose poke一侧的小孔来激发激光。激活右侧迷走神经至孤束核的小鼠很快会增加鼻触小孔的次数以获得更多的激光刺激。而激活左侧迷走神经至后级区的小鼠则对于鼻触小孔的训练表现出无所谓。同时,如果将右侧迷走神经的刺激与特定味觉或者方位进行关联训练。小鼠都会对右侧的迷走刺激做出偏好性的关联,但是左侧刺激却不能形成这一关联。
动物会通过学习压杆自我激活多巴胺系统,那么来自胃肠的右侧迷走神经是通过怎样的神经环路到达多巴胺系统的呢?作者将顺向跨突触感染的疱疹病毒分别注入左侧和右侧的迷走神经节内,发现只有右侧的迷走神经节通过臂旁核与中脑黑质系统相连接,而非左侧。而且右侧的所连接的臂旁核背侧区域与黑质地神经环路也一样能诱导小鼠的自发激活行为。
蛋白质和脂肪的摄入都会刺激肠道内分泌细胞释放胆囊收缩素CCK。胆囊收缩素除了可以刺激胆囊收缩,减缓胃排空,还可以作为中枢信号,刺激多巴胺在纹状体的释放并诱导食物的偏好。研究发现,胆囊收缩的中枢信号调节正是通过右侧迷走—孤束核—臂旁核—黑质—纹状体通路实现的。如果特异性地杀死右侧迷走神经节内表达的胆囊收缩素的细胞,那么胆囊收缩素对于小鼠摄食调节的作用就会消失。
迷走神经作为支配大部分内脏的神经系统,参与不同系统间看似相互独立但又彼此相关的生理功能的感受和调节。随着近年来各种技术手段的快速发展,其相关的研究进展非常迅速。迷走神经对于蛋白质和脂肪的中枢信号传导尤为重要,但是糖分的感受并不单独依赖于迷走神经,其机理将在未来的研究中继续深入下去。
参考文献
1. Bohorquez, D.V., and Liddle, R.A. (2015). The gut connectome: making sense of what you eat. J Clin Invest 125, 888-890.
2. Clemmensen, C., Muller, T.D., Woods, S.C., Berthoud, H.R., Seeley, R.J., and Tschop, M.H. (2017). Gut-Brain Cross-Talk in Metabolic Control. Cell 168, 758-774.
3. de Araujo, I.E., Tellez, L.A., Ferreira, J.G., Ren, X., and Yeckel, C.W. (2012). The gut-brain dopamine axis: A regulatory system of caloric intake. Physiol & Behav 106, 394-399.
4. Diepenbroek, C., Quinn, D., Stephens, R., Zollinger, B., Anderson, S., Pan, A., and de Lartigue, G. (2017). Validation and characterization of a novel method for selective vagal deafferentation of the gut. Am J Physiol 313, G342-G352.
5. Perez, C., and Sclafani, A. (1991). Cholecystokinin conditions flavor preferences in rats. Am J Physiol 260, R179-185.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号