碳氢键官能化作为合成化学领域的研究热点,既有众多领军人物加入掘金阵营,也有无数风云人物诞生其间,经过十几年前赴后继的不懈努力,这个领域已经从一个抽象的概念发展成了初具实际用途的合成利器。然而,到目前为止,如何有效地控制反应的选择性依旧是该领域最大的难题。
为了解决这个难题,无数科学家做了大量的策略探索和方法尝试,总的来说,行之有效的方法可以大致分为三大类。第一类是底物控制法。此方法是依赖某些底物中碳氢键反应活性具有巨大差异,当底物中某个位置的碳氢键参与反应的倾向明显高于其他碳氢键,那么该碳氢键就会被反应体系所“选择”。但是此类方法对底物非常依赖和挑剔,局限性很大。第二类是导向基团法。此方法在控制位置选择性方面的表现非常突出,也是至今最热门和最成熟的方法,但缺点是对官能团的依赖,从本质上依旧无法摆脱对底物的依赖。第三类是催化剂控制法。虽然上述两类方法也使用催化剂,但选择性是由催化剂和底物协同控制。为了摆脱对底物的依赖,发展完全由催化剂控制选择性的催化剂控制法近期得到了越来越多的关注。由于底物的碳氢键都具有各自特定的空间位阻,主流的催化剂控制法是通过设计一系列具有特殊三维结构的催化剂对具有特定空间位阻属性的各类碳氢键进行识别,从而控制反应的选择。
Huw Davies教授课题组的选择性碳氢键官能化工作,选择的正是催化剂控制法,他们的研究目标相当大胆:设计三种催化剂分别实现一级、二级、三级碳氢键(1º, 2º, and 3º C–H bond)的选择性官能化。相关发展思路和催化剂的设计理念(下图),在“从一个低级错误到两篇Nature”(点击阅读详细)一文中进行了详细介绍。他们也已成功地发展了两个分别应用于二级碳氢键(点击阅读详细)和三级碳氢键(点击阅读详细)的选择性官能化反应的高效催化体系。
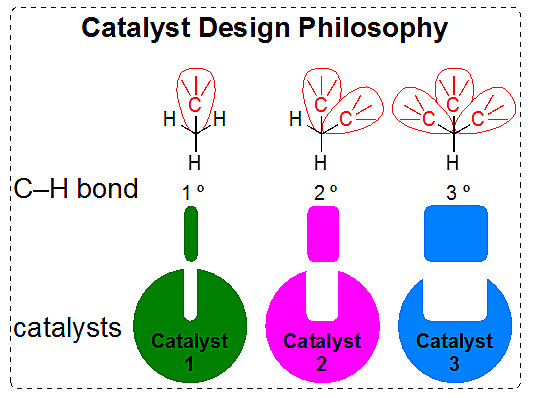
图片来源:廖矿标博士 / Huw Davies教授课题组
一般而言,在两篇Nature 论文的夹缝中,在同一体系再次取得巨大突破并避开“续集”之嫌,将成果发表在高水平期刊上,这非常困难也很罕见。经过全面考量和评估论证,廖矿标博士和Huw Davies教授决定将挑战最大的一级碳氢键研究单独切分并放在故事的最后一环,这是因为挑战越大分量也就越重,如果能取得突破,就非常有希望将故事推向高潮。
纵观烷基碳氢键官能化的相关报道,二级碳氢键和三级碳氢键的研究要远远多于一级碳氢键,其主要原因是在绝大多数的反应体系中,一级碳氢键的反应活性远远低于前两者。同时,要控制反应发生在一级碳氢键,就需要在催化剂的反应位点构建具有非常高空间位阻的三维结构,以阻挡活性更高但位阻较大的二级碳氢键和三级碳氢键。然而,此类催化剂的设计和合成难度非常大,至今仅有少数几个催化剂见诸报道。
可喜的是,廖矿标博士和Huw Davies教授等研究者最终还是取得了成功。近日,他们的工作发表在Nature Chemistry 上,报道了一种新型的三芳基环丙烷羧酸铑催化剂。该催化剂可以实现从简单到复杂化合物一级碳氢键的选择性官能化,大多数反应的选择性都超过了仪器的检测极限值:>98:2 r.r., >99% e.e.(下图)。此文的发表,意味着“发展三个催化剂分别用于一级、二级和三级碳氢键官能化”的设计目标,以近乎完美的方式实现。
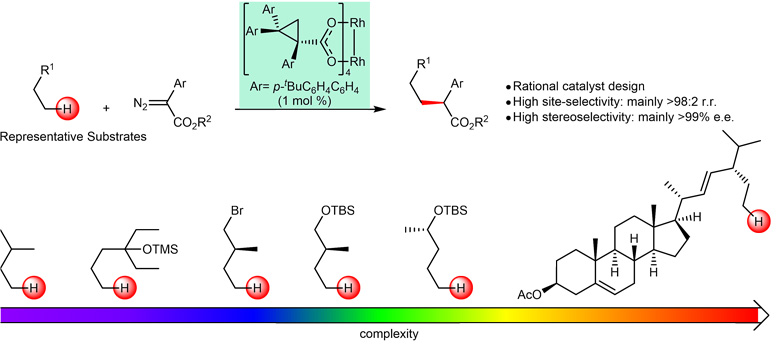
一级碳氢键的选择性官能化。图片来源:Nat. Chem.
在进一步介绍这篇Nat. Chem.文章之前,需要明确一个概念:在金属卡宾诱导的碳氢官能化反应中,羧酸铑等金属络合物并不是控制反应的最终“催化剂”。因为根据反应机理,真正控制反应选择性的是由金属络合物和重氮化合物生成的金属卡宾中间体(下图a)。科学家们普遍认为在金属卡宾中间体形成的过程中,金属络合物的结构并没有发生显著的变化,只是金属络合物三维结构的某些空间被卡宾的基团所填充而形成了更加紧密的三维结构,所以羧酸铑等金属络合物依然被习惯地称为此类反应的催化剂。

催化剂控制的选择性碳氢官能化。图片来源:Nat. Chem.
由于在二级碳氢键选择性官能化反应的研究过程中(点击阅读详细),作者发现竞争反应主要来自于一级碳氢键。虽然在大部分的催化剂反应中,一级碳氢键参与反应的比例都非常低,但是在对位取代的三芳基环丙烷羧酸铑(下图中的催化剂D)催化的戊烷反应中,一级碳氢键与二级碳氢键的相关产物比例高达1:2。由此,研究者大胆地猜测,3,5位取代的催化剂(比如下图中的催化剂C)倾向于识别二级碳氢键,而对位取代的催化剂(下图中的催化剂D-G)则有望成为设计可识别一级碳氢键的催化剂的突破口。经过晶体结构和计算化学的解析(ACS Catal., 2017, 8, 678-682),研究者发现这两类催化剂的空间构型因取代基位置的不同而形成截然不同的三维结构,从而决定了两类催化剂的选择性差异。
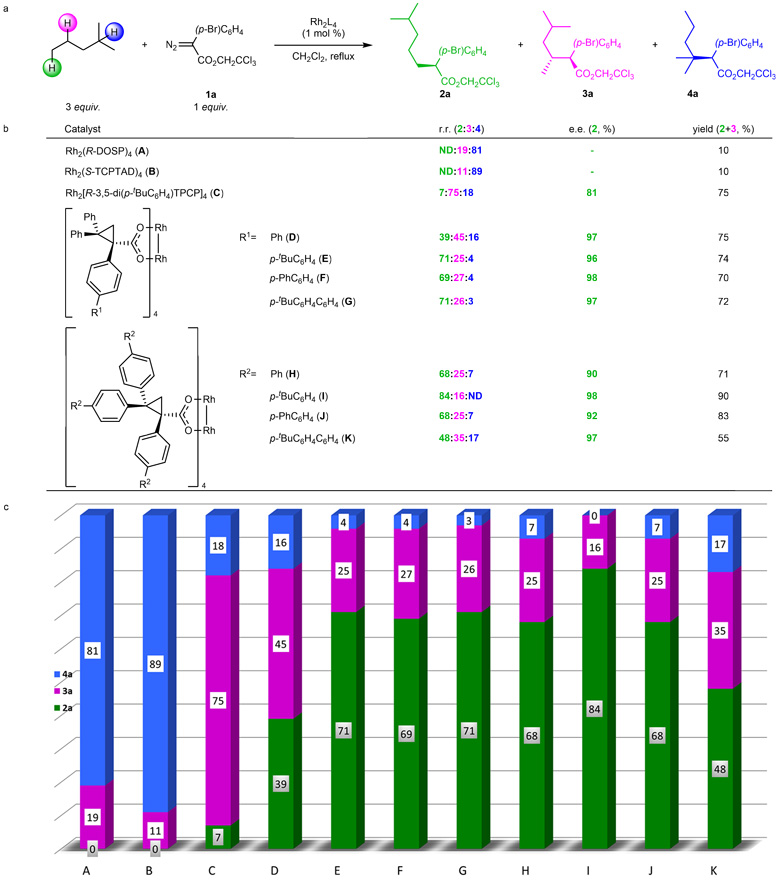
催化剂优化。图片来源:Nat. Chem.
基于此,催化剂的结构设计优化则集中研究不同对位取代基对选择性的影响。在二甲基戊烷为底物的反应结果中可以明显看出,从催化剂D到E,一级碳氢键的相关产物比例明显提高。但是继续“加长”芳基链并不能提高选择性(催化剂F和G)。于是,对环丙烷上的另外两个芳基也采取了同样的策略,在对位引入取代基,正如预料的一样,一级碳氢键的相关产物比例显著提升(催化剂I)。然而,类似的“加长”策略不仅没有帮助,反而降低了选择性(催化剂J和K)。其原因应该是三芳基环丙烷虽然可以保持非常强的刚性结构,但是加入过多的基团超出了结构的负荷极限,紧密的手性口袋结构被迫张开而失去选择性。值得注意的是,不论位置选择性是高是低,此类催化剂的对映异构选择性都非常高,说明底物只能从一个方向靠近卡宾,证明此类催化剂的特殊结构在构建手性口袋方面具有超常的优势。
自此,催化剂I被确定为最佳的催化剂,并对底物范围进行了探索。从下图的结果可以明显看出催化剂I对选择性的控制能力非常强,绝大多数反应的位置选择性和对映异构选择性都超过了仪器的测量极限值(>98:2 r.r., >99% e.e.)。尤其值得注意的是下图化合物9和12的相关反应结果,前者充分证明了催化剂I可以敏锐地识别甲基和乙基间极其细微的空间位阻差异,而后者则充分证明了催化剂I可以清晰地区别乙基和丙基间微妙的空间位阻差异。
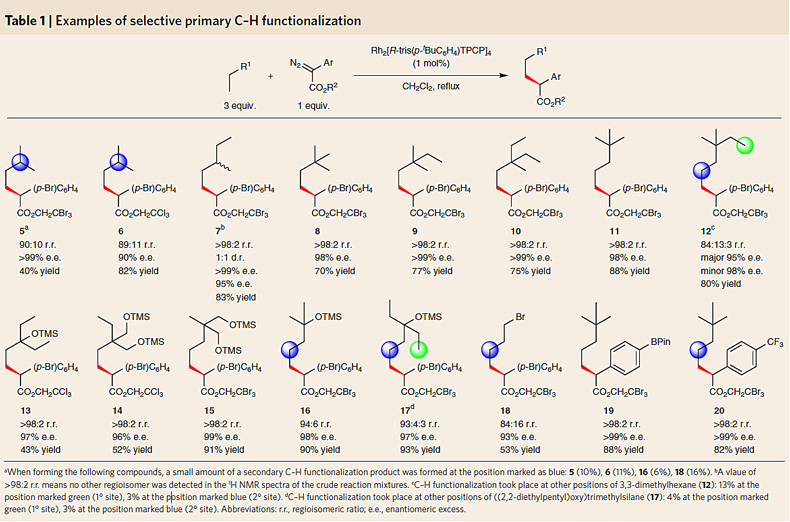
催化剂性能检验。图片来源:Nat. Chem.
催化剂I在对映选择性(enantioselectivity)方面表现出超常的控制力为合成非对映异构纯的(diastereopure)化合物提供了一个非常好的契机。在对手性化合物进行修饰时,不同手性的催化剂可以得到不同的非对映异构纯的产物(下图),说明底物手性中心并没有对反应的立体选择性产生影响,再次证明了催化剂对反应的控制力。

催化剂控制的手性化合物修饰。图片来源:Nat. Chem.
为了进一步研究催化剂在复杂化合物中对一级碳氢键的识别能力,甾体化合物Stigmasteryl acetate被选为研究对象(下图)。当使用Rh2(R-TCPTAD)4时,反应的选择性被控制在三级碳氢键的位置;当使用催化剂I时,反应的选择性则被控制在一级碳氢键的位置。这些结果充分证明了催化剂对空间位阻的敏锐识别能力。
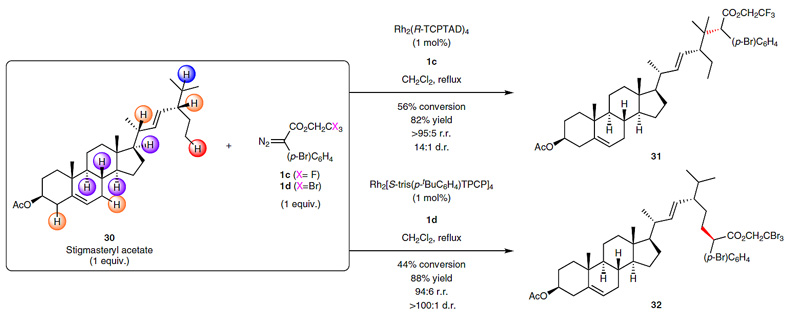
催化剂控制的复杂化合物的选择性修饰。图片来源:Nat. Chem.
为了进一步理解催化剂和金属卡宾结构对选择性的影响因素,作者采用ONIOM计算方法对催化剂和金属卡宾结构进行分析。计算结果表明,催化剂I倾向于形成C2对称的三维结构,并且底物倾向于从Si 面进攻卡宾,与实验结果相吻合。
至此,廖矿标博士和Huw Davies教授等研究者设计和发展出了一种手性催化剂,该催化剂可以高效地控制一级碳氢键的选择性官能化反应。在此前两篇Nature 工作的夹缝中,成功地“挤出”了一篇Nature Chemistry。同时,一级碳氢键选择性官能化的突破性进展再次强有力地证明了催化剂控制法的可行性,表现出了催化剂控制法的巨大发展潜力。