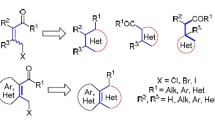
This review examines current trends in the use of readily accessible acyclic enaminodiones in the synthesis of heterocyclic structures, including medicinal and natural compounds. Enaminodiones are latent tricarbonyl compounds, therefore their synthetic use exploits mainly their electrophilic properties. In addition, they can act as C-nucleophiles and participate in formal (4+2) cycloaddition reactions as ambiphilic reagents, as well as key intermediates in intramolecular cyclizations. The review analyzes the literature published in 2012–2019; the systematization is based on the structure of the formed heterocycle. The bibliography of the review includes 97 sources.

Similar content being viewed by others
References
(a) Stanovnik, B.; Svete, J. Chem. Rev. 2004, 104, 2433. (b) Abu-Shanab, F. A.; Sherif, S. M.; Mousa, S. A. S. J. Heterocycl. Chem. 2009, 46, 801. (c) Shawali, A. S. ARKIVOC 2012, (i), 383. c Stanovnik, B. Eur. J. Org. Chem. 2019, 5120. d Granik, V. G. Preparativnaya khimiya atsetalei amidov i laktamov (Preparative Chemistry of Amide and Lactam Acetals [in Russian]); Moscow: Vuzovskaya kniga, 2011.
(a) Hughes, D. L. Org. Process Res. Dev. 2019, 23, 716. (b) Schreiner, E.; Richter, F.; Nerdinger, S. In Topics in Heterocyclic Chemistry; Maes, B.; Cossy, J.; Polanc, S., Eds.; Springer, 2016, vol. 44, p. 187. b Yasukata, T.; Aoyama, Y. J. Synth. Org. Chem., Jpn. 2020, 78, 2.
Lin, H.; Dai, C.; Jamison, T. F.; Jensen, K. F. Angew. Chem., Int. Ed. 2017, 56, 8870.
(a) Toda, N.; Hao, X.; Ogawa, Y.; Oda, K.; Yu, M.; Fu, Z.; Chen, Y.; Kim, Y.; Lizarzaburu, M.; Lively, S.; Lawlis, S.; Murakoshi, M.; Nara, F.; Watanabe, N.; Reagan, J. D.; Tian, H.; Fu, A.; Motani, A.; Liu, Q.; Lin, Y.-J.; Zhuang, R.; Xiong, Y.; Fan, P.; Medina, J.; Li, L.; Izumi, M.; Okuyama, R.; Shibuya, S. ACS Med. Chem. Lett. 2013, 4, 790. (b) Scott, J. S.; deSchoolmeester, J.; Kilgour, E.; Mayers, R. M.; Packer, M. J.; Hargreaves, D.; Gerhardt, S.; Ogg, D. J.; Rees, A.; Selmi, N.; Stocker, A.; Swales, J. G.; Whittamore, P. R. O. J. Med. Chem. 2012, 55, 10136. (c) Raeppel, F.; Raeppel, S. L.; Therrien, E. Bioorg. Med. Chem. Lett. 2015, 25, 3810. (d) Hanan, E. J.; van Abbema, A.; Barrett, K.; Blair, W. S.; Blaney, J.; Chang, C.; Eigenbrot, C.; Flynn, S.; Gibbons, P.; Hurley, C. A.; Kenny, J. R.; Kulagowski, J.; Lee, L.; Magnuson, S. R.; Morris, C.; Murray, J.; Pastor, R. M.; Rawson, T.; Siu, M.; Ultsch, M.; Zhou, A.; Sampath, D.; Lyssikatos, J. P. J. Med. Chem. 2012, 55, 10090. (e) Jia, H.; Bai, F.; Liu, N.; Liang, X.; Zhan, P.; Ma, C.; Jiang, X.; Liu, X. Eur. J. Med. Chem. 2016, 123, 202. (f) Pendri, A.; Dodd, D. S.; Chen, J.; Cvijic, M. E.; Kang, L.; Baska, R. A.; Carlson, K. E.; Burford, N. T.; Sun, C.; Ewing, W. R.; Gerritz, S. W. ACS Comb. Sci. 2012, 14, 197. (g) Yang, W.; Li, Y.; Ai, Y.; Obianom, O. N.; Guo, D.; Yang, H.; Sakamuru, S.; Xia, M.; Shu, Y.; Xue, F. J. Med. Chem. 2019, 62, 11151. (h) Vekariya, M. K.; Vekariya, R. H.; Brahmkshatriya, P. S.; Shah, N. K. Chem. Biol. Drug Des. 2018, 92, 1683. (i) Ali, K. A.; Elsayed, M. A.; Farag, A. M. Heterocycles 2012, 85, 1913.
a Grošelj, U.; Pušavec, E.; Golobič, A.; Dahmann, G.; Stanovnik, B.; Svete, J. Tetrahedron 2015, 71, 109. (b) Francis, S.; Croft, D.; Schüttelkopf, A. W.; Parry, C.; Pugliese, A.; Cameron, K.; Claydon, S.; Drysdale, M.; Gardner, C.; Gohlke, A.; Goodwin, G.; Gray, C. H.; Konczal, J.; McDonald, L.; Mezna, M.; Pannifer, A.; Paul, N. R.; Machesky, L.; McKinnon, H.; Bower, J. Bioorg. Med. Chem. Lett. 2019, 29, 1023.
Silva, M. J. V.; Silva, R. G. M.; Melo, U. Z.; Gonçalves, D. S.; Back, D. F.; Moura, S.; Pontes, R. M.; Basso, E. A.; Gauze, G. F.; Rosa, F. A. RSC Adv. 2016, 6, 290.
Jacomini, A. P.; Silva, M. J. V.; Silva, R. G. M.; Gonçalves, D. S.; Volpato, H.; Basso, E. A.; Paula, F. R.; Nakamura, C. V.; Sarragiotto, M. H.; Rosa, F. A. Eur. J. Med. Chem. 2016, 124, 340.
Jacomini, A. P.; Silva, M. J. V.; Poletto, J.; Ribeiro, G. M.; Yokoyama, J. T. C.; Bidóia, D. L.; Paula, F. R.; Nakamura, C. V.; Sarragiotto, M. H.; Rosa, F. A. J. Braz. Chem. Soc. 2018, 29, 2657.
Souza, T. F.; Silva, M. J. V.; Silva, R. G. M.; Gonçalves, D. S.; Simon, P. A.; Jacomini, A. P.; Basso, E. A.; Moura, S.; Martins, M. A. P.; Back, D. F.; Rosa, F. A. Asian J. Org. Chem. 2016, 6, 627.
Silva, M. J. V.; Poletto, J.; Jacomini, A. P.; Pianoski, K. E.; Gonçalves, D. S.; Ribeiro, G. M.; Melo, S. M. S.; Back, D. F.; Moura, S.; Rosa, F. A. J. Org. Chem. 2017, 82, 12590.
van der Zouwen, A. J.; Lohse, J.; Wieske, L. H. E.; Hohmann, K. F.; van der Vlag, R.; Witte, M. D. Chem. Commun. 2019, 55, 2050.
Silva, R. G. M.; Silva, M. J. V.; Jacomini, A. P.; Moura, S.; Back, D. F.; Basso, E. A.; Rosa, F. A. RSC Adv. 2018, 8, 4773.
(a) Yuan, J.; Rao, C. B.; Zhang, Q.; Zhang, R.; Liang, Y.; Zhang, N.; Dong, D. Synthesis 2018, 1875. (b) Li, C.; Yuan, J.; Zhang, Q.; Rao, C. B.; Zhang, R.; Zhao, Y.; Deng, B.; Dong, D. J. Org. Chem. 2018, 83, 14999.
Shi, Z.; Kiau, S.; Lobben, P.; Hynes, J., Jr.; Wu, H.; Parlanti, L.; Discordia, R.; Doubleday, W. W.; Leftheris, K.; Dyckman, A. J.; Wrobleski, S. T.; Dambalas, K.; Tummala, S.; Leung, S.; Lo, E. Org. Process Res. Dev. 2012, 16, 1618.
Grošelj, U.; Žorž, M.; Golobič, A.; Stanovnik, B.; Svete, J. Tetrahedron 2013, 69, 11092.
White, J. D.; Li, Y. Heterocycles 2014, 88, 899.
(a) Schmitt, E.; Commare, B.; Panossian, A.; Vors, J.-P.; Pazenok, S.; Leroux, F. R. Chem.–Eur. J. 2018, 24, 1311. (b) Kaping, S.; Kalita, U.; Sunn, M.; Singha, L. I.; Vishwakarma, J. N. Monatsh. Chem. 2016, 147, 1257. n(c) Castillo, J.-C.; Rosero, H.-A.; Portilla, J. RSC Adv. 2017, 7, 28483. c Črček, B.; Baškovč, J.; Grošelj, U.; Kočar, D.; Dahmann, G.; Stanovnik, B.; Svete, J. Molecules 2012, 17, 5363. d Abdelrazek, F. M.; Elkholy, Y. M.; Salah, A. M.; Abdelazeem, N. M.; Metz, P. J. Heterocycl. Chem. 2014, 51, 824. e Scott, J. S.; Gill, A. L.; Godfrey, L.; Groombridge, S. D.; Rees, A.; Revill, J.; Schofield, P.; Sörme, P.; Stocker, A.; Swales, J. G.; Whittamore, P. R. O. Bioorg. Med. Chem. Lett. 2012, 22, 6756. f Lopes, A. B.; Miguez, E.; Kümmerle, A. E.; Rumjanek, V. M.; Fraga, C. A. M.; Barreiro, E. J. Molecules 2013, 18, 11683. g Islam, S.; Firestine, S. M. J. Heterocycl. Chem. 2013, 50, 1043. h Debenham, J. S.; Madsen-Duggan, C.; Clements, M. J.; Walsh, T. F.; Kuethe, J. T.; Reibarkh, M.; Salowe, S. P.; Sonatore, L. M.; Hajdu, R.; Milligan, J. A.; Visco, D. M.; Zhou, D.; Lingham, R. B.; Stickens, D.; DeMartino, J. A.; Tong, X.; Wolff, M.; Pang, J.; Miller, R. R.; Sherer, E. C.; Hale, J. J. J. Med. Chem. 2016, 59, 11039.
Gonçalves, D. S.; Silva, M. J. V.; Souza, T. F.; Jacomini, A. P.; Back, D. F.; Basso, E. A.; Moura, S.; Rosa, F. A. Synthesis 2016, 3042.
Campos, P. T.; Rodrigues, L. V.; Belladona, A. L.; Bender, C. R.; Bitencurt, J. S.; Rosa, F. A.; Back, D. F.; Bonacorso, H. G.; Zanatta, N.; Frizzo, C. P.; Martins, M. A. P. Beilstein J. Org. Chem. 2017, 13, 257.
Andrade, V. P.; Mittersteiner, M.; Bonacorso, H. G.; Frizzo, C. P.; Martins, M. A. P.; Zanatta, N. Synthesis 2019, 2311.
(a) Kong, D.; Xue, T.; Guo, B.; Cheng, J.; Liu, S.; Wei, J.; Lu, Z.; Liu, H.; Gong, G.; Lan, T.; Hu, W.; Yang, Y. J. Med. Chem. 2019, 62, 3088. (b) Andersen, S. M.; Aurell, C.-J.; Zetterberg, F.; Bollmark, M.; Ehrl, R.; Schuisky, P.; Witt, A. Org. Process Res. Dev. 2013, 17, 1543.
Gao, B.; Dong, D.; Zhang, J.; Ding, C.; Dong, C.; Liang, Y.; Zhang, R. Synthesis 2012, 201.
Tsizorik, N. M.; Hrynyshyn, Y. V.; Musiychuk, A. R.; Bol'but, A. V.; Vovk, M. V. Chem. Heterocycl. Compd. 2019, 55, 893. [Khim. Geterotsikl. Soedin. 2019, 55, 893.]
Baškovč, J.; Dahmann, G.; Golobič, A.; Grošelj, U.; Kočar, D.; Stanovnik, B.; Svete, J. ACS Comb. Sci. 2012, 14, 513.
Gao, B.-C.; Sun, Y.-F.; Wang, J.; Zu, L.-W.; Zhang, X.; Liu, W.-B. J. Heterocycl. Chem. 2018, 55, 2732.
Zhang, Q.; Liu, X.; Xin, X.; Zhang, R.; Liang, Y.; Dong, D. Chem. Commun. 2014, 50, 15378.
(a) Wang, H.; Kowalski, M. D.; Lakdawala, A. S.; Vogt, F. G.; Wu, L. Org. Lett. 2015, 17, 564. (b) Miyagawa, M.; Akiyama, T.; Mikamiyama-Iwata, M.; Hattori, K.; Kurihara, N.; Taoda, Y.; Takahashi-Kageyama, C.; Kurose, N.; Mikamiyama, H.; Suzuki, N.; Takaya, K.; Tomita, K.; Matsuo, K.; Morimoto, K.; Yoshida, R.; Shishido, T.; Yoshinaga, T.; Sato, A.; Kawai, M. Bioorg. Med. Chem. Lett. 2016, 26, 4739.
Ziegler, R. E.; Desai, B. K.; Jee, J.-A.; Gupton, B. F.; Roper, T. D.; Jamison, T. F. Angew. Chem., Int. Ed. 2018, 57, 7181.
Obydennov, D. L.; El-Tantawy, A. I.; Sosnovskikh, V. Ya. New J. Chem. 2018, 42, 8943.
(a) Obydennov, D. L.; Sidorova, E. S.; Usachev, B. I.; Sosnovskikh, V. Ya. Tetrahedron Lett. 2013, 54, 3085. (b) Obydennov, D. L.; Suslova, A. I.; Sosnovskikh, V. Ya. Chem. Heterocycl. Compd. 2020, 56, 173. [Khim. Geterotsikl. Soedin. 2020, 56, 173.]
(a) Han, X.; Javanbakht, H.; Jiang, M.; Liang, C.; Wang, J.; Wang, Y.; Wang, Z.; Weikert, R. J.; Yang, S.; Zhou, C. WO Patent 2015/113990. (b) Cheng, Z.; Han, X.; Liang, C.; Yang, S. WO Patent 2017/13046.
(a) Obydennov, D. L.; Röschenthaler, G.-V.; Sosnovskikh, V. Ya. Tetrahedron Lett. 2013, 54, 6545. (b) Obydennov, D. L.; Röschenthaler, G.-V.; Sosnovskikh, V. Ya. Tetrahedron Lett. 2014, 55, 472. (c) Obydennov, D. L.; Goncharov, A. O.; Sosnovskikh, V. Ya. Russ. Chem. Bull., Int. Ed. 2016, 65, 2233. [Izv. Akad. Nauk, Ser. Khim. 2016, 2233.]
(a) Gerlach, E. M.; Korkmaz, M. A.; Pavlinov, I.; Gao, Q.; Aldrich, L. N. ACS Chem. Biol. 2019, 14, 1536. (b) Shu, L.; Gu, C.; Dong, Y.; Brinkman, R. Org. Process Res. Dev. 2012, 16, 1940. (c) El Bakali, J.; Gilleron, P.; Body-Malapel, M.; Mansouri, R.; Muccioli, G. G.; Djouina, M.; Barczyk, A.; Klupsch, F.; Andrzejak, V.; Lipka, E.; Furman, C.; Lambert, D. M.; Chavatte, P.; Desreumaux, P.; Millet, R. J. Med. Chem. 2012, 55, 8948.
Zhou, H.; Li, L.; Wu, C.; Kurtán, T.; Mándi, A.; Liu, Y.; Gu, Q.; Zhu, T.; Guo, P.; Li, D. J. Nat. Prod. 2016, 79, 1783.
(a) Agrawal, A.; DeSoto, J.; Fullagar, J. L.; Maddali, K.; Rostami, S.; Richman, D. D.; Pommier, Y.; Cohen, S. M. Proc. Natl. Acad. Sci. U. S. A. 2012, 109, 2251. (b) Hare, S.; Vos, A. M.; Clayton, R. F.; Thuring, J. W.; Cummings, M. D.; Cherepanov, P. Proc. Natl. Acad. Sci. U. S. A. 2010, 107, 20057. (с) Wang, L.; Sarafianos, S. G.; Wang, Z. Acc. Chem. Res. 2020, 53, 218.
Yasukata, T.; Masui, M.; Ikarashi, F.; Okamoto, K.; Kurita, T.; Nagai, M.; Sugata, Y.; Miyake, N.; Hara, S.; Adachi, Y.; Sumino, Y. Org. Process Res. Dev. 2019, 23, 565.
Miyagawa, M.; Akiyama, T.; Taoda, Y.; Takaya, K.; Takahashi-Kageyama, C.; Tomita, K.; Yasuo, K.; Hattori, K.; Shano, S.; Yoshida, R.; Shishido, T.; Yoshinaga, T.; Sato, A.; Kawai, M. J. Med. Chem. 2019, 62, 8101.
(a) Kankanala, J.; Wang, Y.; Geraghty, R. J.; Wang, Z. ChemMedChem 2018, 13, 1658. (b) Kankanala, J.; Kirby, K. A.; Liu, F.; Miller, L.; Nagy, E.; Wilson, D. J.; Parniak, M. A.; Sarafianos, S. G.; Wang, Z. J. Med. Chem. 2016, 59, 5051.
Obydennov, D. L.; Viktorova, V. V.; Chernyshova, E. V.; Shirinkin, A. S.; Usachev, S. A.; Sosnovskikh, V. Ya. Synthesis 2020, 2267.
Hu, X.; Ding, A.; Sun, N.; Hu, B.; Shen, Z.; Jin, L. Org. Process Res. Dev. 2019, 23, 2439.
Clarke, P. A.; Nasir, N. M.; Sellars, P. B.; Peter, A. M.; Lawson, C. A.; Burroughs, J. L. Org. Biomol. Chem. 2016, 14, 6840.
(a) You, Z.-H.; Chen, Y.-H.; Tang, Y.; Liu, Y.-K. Org. Lett. 2019, 21, 8358. (b) Bornadiego, A.; Díaz, J.; Marcos, C. F. Org. Biomol. Chem. 2019, 17, 1410.
Sambaiah, M.; Raghavulu, K.; Kumar, K. S.; Yennam, S.; Behera, M. New J. Chem. 2017, 41, 10020.
(a) Iaroshenko, V. O.; Savych, I.; Villinger, A.; Sosnovskikh, V. Ya.; Langer, P. Org. Biomol. Chem. 2012, 10, 9344. (b) Bornadiego, A.; Díaz, J.; Marcos, C. F. Adv. Synth. Catal. 2014, 356, 718.
Píša, O.; Rádl, S. Eur. J. Org. Chem. 2016, 2336.
Rádl, S.; Stach, J.; Píša, O.; Cinibulk, J.; Havlíček, J.; Zajícová, M.; Pekárek, T. J. Heterocycl. Chem. 2016, 53, 1738.
(a) Mao, T.-Q.; He, Q.-Q.; Wan, Z.-Y.; Chen, W.-X.; Chen, F.-E.; Tang, G.-F.; De Clercq, E.; Daelemans, D.; Pannecouque, C. Bioorg. Med. Chem. 2015, 23, 3860. (b) Zhi, Y.; Gao, L.-X.; Jin, Y.; Tang, C.-L.; Li, J.-Y.; Li, J.; Long, Y.-Q. Bioorg. Med. Chem. 2014, 22, 3670. (c) Komoriya, S.; Odagiri, T.; Inagaki, H.; Nagamochi, M.; Miyauchi, R.; Yoshida, K.; Kitamura, T.; Takahashi, H. Chem. Pharm. Bull. 2019, 67, 47. (d) Li, S.; Jiang, R.; Qin, M.; Liu, H.; Zhang, G.; Gong, P. Arch. Pharm. Chem. Life Sci. 2013, 346, 521. (e) Zheng, H.; Liu, J.; Zhang, P. Med. Chem. Res. 2012, 21, 53.
(a) Dembélé, O.; Montoir, D.; Yvorra, T.; Sérillon, D.; Tonnerre, A.; Duflos, M.; Robert, J.-M.; Bazin, M.-A. Tetrahedron Lett. 2018, 59, 3519. (b) Bunce, R. A.; Nammalwar, B. J. Heterocycl. Chem. 2012, 49, 658. (c) Donalisio, M.; Massari, S.; Argenziano, M.; Manfroni, G.; Cagno, V.; Civra, A.; Sabatini, S.; Cecchetti, V.; Loregian, A.; Cavalli, R.; Lembo, D.; Tabarrini, O. J. Med. Chem. 2014, 57, 5649. (d) Massari, S.; Mercorelli, B.; Sancineto, L.; Sabatini, S.; Cecchetti, V.; Gribaudo, G.; Palù, G.; Pannecouque, C.; Loregian, A.; Tabarrini, O. ChemMedChem 2013, 8, 1403. (e) Manfroni, G.; Cannalire, R.; Barreca, M. L.; Kaushik-Basu, N.; Leyssen, P.; Winquist, J.; Iraci, N.; Manvar, D.; Paeshuyse, J.; Guhamazumder, R.; Basu, A.; Sabatini, S.; Tabarrini, O.; Danielson, U. H.; Neyts, J.; Cecchetti, V. J. Med. Chem. 2014, 57, 1952. (f) Al-Qawasmeh, R. A.; Abadleh, M. M.; Zahra, J. A.; El-Abadelah, M. M.; Albashiti, R.; Zani, F.; Incerti, M.; Vicini, P. J. Enzyme Inhib. Med. Chem. 2014, 29, 777.
He, Y.; Xu, Q.; Ma, W.; Zhang, J.; Sun, H.; Shen, J. Heterocycles 2014, 89, 1035.
Obydennov, D. L.; Chernyshova, E. V.; Sosnovskikh, V. Ya. J. Org. Chem. 2019, 84, 6491.
Reiher, C. A.; Shenvi, R. A. J. Am. Chem. Soc. 2017, 139, 3647.
Acknowledgment
The review was prepared with the financial support of the Russian Science Foundation (grant 18-73-00186).
Author information
Authors and Affiliations
Corresponding author
Additional information
Translated from Khimiya Geterotsiklicheskikh Soedinenii, 2020, 56(10), 1241–1253
Rights and permissions
About this article
Cite this article
Obydennov, D.L., Chernyshova, E.V. & Sosnovskikh, V.Y. Acyclic Enaminodiones in the Synthesis of Heterocyclic Compounds. Chem Heterocycl Comp 56, 1241–1253 (2020). https://doi.org/10.1007/s10593-020-02807-0
Received:
Accepted:
Published:
Issue Date:
DOI: https://doi.org/10.1007/s10593-020-02807-0