当前位置:
X-MOL 学术
›
JAMA Dermatol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Efficacy and Safety of Multiple Dupilumab Dose Regimens After Initial Successful Treatment in Patients With Atopic Dermatitis: A Randomized Clinical Trial.
JAMA Dermatology ( IF 10.9 ) Pub Date : 2019-12-26 , DOI: 10.1001/jamadermatol.2019.3617 Margitta Worm 1 , Eric L Simpson 2 , Diamant Thaçi 3 , Robert Bissonnette 4 , Jean-Philippe Lacour 5 , Stefan Beissert 6 , Makoto Kawashima 7 , Carlos Ferrándiz 8 , Catherine H Smith 9 , Lisa A Beck 10 , Kuo-Chen Chan 11 , Zhen Chen 11 , Bolanle Akinlade 11 , Thomas Hultsch 12 , Heribert Staudinger 13 , Abhijit Gadkari 11 , Laurent Eckert 14 , John D Davis 11 , Manoj Rajadhyaksha 11 , Neil M H Graham 11 , Gianluca Pirozzi 13 , Neil Stahl 11 , George D Yancopoulos 11 , Marius Ardeleanu 11
JAMA Dermatology ( IF 10.9 ) Pub Date : 2019-12-26 , DOI: 10.1001/jamadermatol.2019.3617 Margitta Worm 1 , Eric L Simpson 2 , Diamant Thaçi 3 , Robert Bissonnette 4 , Jean-Philippe Lacour 5 , Stefan Beissert 6 , Makoto Kawashima 7 , Carlos Ferrándiz 8 , Catherine H Smith 9 , Lisa A Beck 10 , Kuo-Chen Chan 11 , Zhen Chen 11 , Bolanle Akinlade 11 , Thomas Hultsch 12 , Heribert Staudinger 13 , Abhijit Gadkari 11 , Laurent Eckert 14 , John D Davis 11 , Manoj Rajadhyaksha 11 , Neil M H Graham 11 , Gianluca Pirozzi 13 , Neil Stahl 11 , George D Yancopoulos 11 , Marius Ardeleanu 11
Affiliation
|
Importance
The dupilumab regimen of 300 mg every 2 weeks is approved for uncontrolled, moderate to severe atopic dermatitis (AD).
Objective
To assess the efficacy and safety of different dupilumab regimens in maintaining response after 16 weeks of initial treatment.
Design, Setting, and Participants
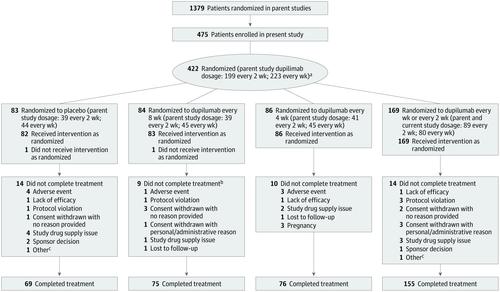
The Study to Confirm the Efficacy and Safety of Different Dupilumab Dose Regimens in Adults With Atopic Dermatitis (LIBERTY AD SOLO-CONTINUE) was a randomized, double-blind, phase 3 clinical trial conducted from March 25, 2015, to October 18, 2016, at 185 sites in North America, Europe, Asia, and Japan. Patients with moderate to severe AD who received dupilumab treatment and achieved an Investigator's Global Assessment score of 0 or 1 or 75% improvement in Eczema Area and Severity Index scores (EASI-75) at week 16 in 2 previous dupilumab monotherapy trials (LIBERTY AD SOLO 1 and 2) were rerandomized in SOLO-CONTINUE. After completing SOLO-CONTINUE, patients were followed up for up to 12 weeks or enrolled in an open-label extension. Data were analyzed from December 5 to 12, 2016.
Interventions
High-responding patients treated with dupilumab in SOLO were rerandomized 2:1:1:1 to continue their original regimen of dupilumab, 300 mg, weekly or every 2 weeks or to receive dupilumab, 300 mg, every 4 or 8 weeks or placebo for 36 weeks.
Main Outcomes and Measures
Percentage change in EASI score from baseline during the SOLO-CONTINUE trial, percentage of patients with EASI-75 at week 36, and safety.
Results
Among the 422 patients (mean [SD] age, 38.2 [14.5] years; 227 [53.8%] male), continuing dupilumab treatment once weekly or every 2 weeks maintained optimal efficacy, with negligible change in percent EASI improvement from SOLO 1 and 2 baseline during the SOLO-CONTINUE trial (-0.06%; P < .001 vs placebo); percent change with the other regimens dose-dependently worsened (dupilumab every 4 weeks, -3.84%; dupilumab every 8 weeks, -6.84%; placebo, -21.67%). More patients taking dupilumab weekly or every 2 weeks (116 of 162 [71.6%]; P < .001 vs placebo) maintained EASI-75 response than those taking dupilumab every 4 weeks (49 of 84 [58.3%]) or every 8 weeks (45 of 82 [54.9%]) or those taking placebo (24 of 79 [30.4%]). Overall adverse event incidences were 70.7% in the weekly or every 2 weeks group, 73.6% in the every 4 weeks group, 75.0% in the every 8 weeks group, and 81.7% in the placebo group. Treatment groups had similar conjunctivitis rates. Treatment-emergent antidrug antibody incidence was lower with more frequent dupilumab dose regimens (11.3% in the placebo group and 11.7%, 6.0%, 4.3%, and 1.2% in the dupilumab every 8 weeks, every 4 weeks, every 2 weeks, and weekly groups, respectively).
Conclusions and Relevance
In this trial, continued response over time was most consistently maintained with dupilumab administered weekly or every 2 weeks. Longer dosage intervals and placebo resulted in a diminution of response for both continuous and categorical end points. No new safety signals were observed. The approved regimen of 300 mg of dupilumab every 2 weeks is recommended for long-term treatment.
Trial Registration
ClinicalTrials.gov identifier: NCT02395133.
中文翻译:

特应性皮炎患者初始成功治疗后多重 Dupilumab 剂量方案的疗效和安全性:一项随机临床试验。
重要性 每 2 周 300 mg 的 dupilumab 方案被批准用于治疗不受控制的中度至重度特应性皮炎 (AD)。目的评估不同 dupilumab 方案在初始治疗 16 周后维持反应的有效性和安全性。设计、设置和参与者 确认不同 Dupilumab 剂量方案对成人特应性皮炎的疗效和安全性的研究 (LIBERTY AD SOLO-CONTINUE) 是一项随机、双盲、3 期临床试验,于 2015 年 3 月 25 日开始,到 2016 年 10 月 18 日,在北美、欧洲、亚洲和日本的 185 个站点。接受 dupilumab 治疗并获得研究者的中度至重度 AD 患者 在 2 项先前的 dupilumab 单药治疗试验(LIBERTY AD SOLO 1 和 2)中,在第 16 周时湿疹面积和严重程度指数评分 (EASI-75) 改善 0 或 1 或 75% 的总体评估评分在 SOLO-CONTINUE 中重新随机化。完成 SOLO-CONTINUE 后,对患者进行长达 12 周的随访或参加开放标签扩展。数据分析时间为 2016 年 12 月 5 日至 12 日。 干预 在 SOLO 中接受 dupilumab 治疗的高反应患者以 2:1:1:1 的比例重新随机化,以继续其最初的 dupilumab 方案,每周或每 2 周 300 mg,或接受 dupilumab , 300 mg,每 4 或 8 周或安慰剂,持续 36 周。主要结果和测量 SOLO-CONTINUE 试验期间 EASI 评分相对于基线的百分比变化、第 36 周时 EASI-75 患者的百分比以及安全性。结果 在 422 名患者中(平均 [SD] 年龄,38. 2 [14.5] 年;227 [53.8%] 男性),每周一次或每 2 周继续 Dupilumab 治疗保持最佳疗效,在 SOLO-CONTINUE 试验期间,EASI 改善百分比从 SOLO 1 和 2 基线的变化可以忽略不计(-0.06%;P < .001 vs安慰剂); 其他方案的变化百分比呈剂量依赖性恶化(dupilumab 每 4 周一次,-3.84%;dupilumab 每 8 周一次,-6.84%;安慰剂,-21.67%)。与每 4 周或每 8 周服用 dupilumab 的患者相比,每周或每 2 周服用一次 dupilumab 的患者(162 名中的 116 名 [71.6%];P < .001 与安慰剂相比)保持 EASI-75 反应的患者更多(84 名中的 49 名 [58.3%])或每 8 周服用一次(82 人中的 45 人 [54.9%])或服用安慰剂的人(79 人中的 24 人 [30.4%])。每周或每 2 周组的总体不良事件发生率为 70.7%,每 4 周组为 73.6%,每 8 周组为 75.0%,81。安慰剂组为 7%。治疗组的结膜炎发生率相似。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。治疗组的结膜炎发生率相似。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。治疗组的结膜炎发生率相似。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。分别为每 4 周、每 2 周和每周组)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。分别为每 4 周、每 2 周和每周组)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。
更新日期:2020-02-12
中文翻译:

特应性皮炎患者初始成功治疗后多重 Dupilumab 剂量方案的疗效和安全性:一项随机临床试验。
重要性 每 2 周 300 mg 的 dupilumab 方案被批准用于治疗不受控制的中度至重度特应性皮炎 (AD)。目的评估不同 dupilumab 方案在初始治疗 16 周后维持反应的有效性和安全性。设计、设置和参与者 确认不同 Dupilumab 剂量方案对成人特应性皮炎的疗效和安全性的研究 (LIBERTY AD SOLO-CONTINUE) 是一项随机、双盲、3 期临床试验,于 2015 年 3 月 25 日开始,到 2016 年 10 月 18 日,在北美、欧洲、亚洲和日本的 185 个站点。接受 dupilumab 治疗并获得研究者的中度至重度 AD 患者 在 2 项先前的 dupilumab 单药治疗试验(LIBERTY AD SOLO 1 和 2)中,在第 16 周时湿疹面积和严重程度指数评分 (EASI-75) 改善 0 或 1 或 75% 的总体评估评分在 SOLO-CONTINUE 中重新随机化。完成 SOLO-CONTINUE 后,对患者进行长达 12 周的随访或参加开放标签扩展。数据分析时间为 2016 年 12 月 5 日至 12 日。 干预 在 SOLO 中接受 dupilumab 治疗的高反应患者以 2:1:1:1 的比例重新随机化,以继续其最初的 dupilumab 方案,每周或每 2 周 300 mg,或接受 dupilumab , 300 mg,每 4 或 8 周或安慰剂,持续 36 周。主要结果和测量 SOLO-CONTINUE 试验期间 EASI 评分相对于基线的百分比变化、第 36 周时 EASI-75 患者的百分比以及安全性。结果 在 422 名患者中(平均 [SD] 年龄,38. 2 [14.5] 年;227 [53.8%] 男性),每周一次或每 2 周继续 Dupilumab 治疗保持最佳疗效,在 SOLO-CONTINUE 试验期间,EASI 改善百分比从 SOLO 1 和 2 基线的变化可以忽略不计(-0.06%;P < .001 vs安慰剂); 其他方案的变化百分比呈剂量依赖性恶化(dupilumab 每 4 周一次,-3.84%;dupilumab 每 8 周一次,-6.84%;安慰剂,-21.67%)。与每 4 周或每 8 周服用 dupilumab 的患者相比,每周或每 2 周服用一次 dupilumab 的患者(162 名中的 116 名 [71.6%];P < .001 与安慰剂相比)保持 EASI-75 反应的患者更多(84 名中的 49 名 [58.3%])或每 8 周服用一次(82 人中的 45 人 [54.9%])或服用安慰剂的人(79 人中的 24 人 [30.4%])。每周或每 2 周组的总体不良事件发生率为 70.7%,每 4 周组为 73.6%,每 8 周组为 75.0%,81。安慰剂组为 7%。治疗组的结膜炎发生率相似。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。治疗组的结膜炎发生率相似。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。治疗组的结膜炎发生率相似。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。使用更频繁的 dupilumab 给药方案时,治疗中出现的抗药抗体发生率较低(安慰剂组为 11.3%,dupilumab 每 8 周、每 4 周、每 2 周和 11.7%、6.0%、4.3% 和 1.2%)每周组,分别)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。分别为每 4 周、每 2 周和每周组)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。分别为每 4 周、每 2 周和每周组)。结论和相关性 在该试验中,每周或每 2 周给药一次 dupilumab 最能始终如一地保持持续反应。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。更长的给药间隔和安慰剂导致连续和分类终点的反应减弱。没有观察到新的安全信号。推荐经批准的每 2 周 300 mg dupilumab 方案用于长期治疗。试验注册 ClinicalTrials.gov 标识符:NCT02395133。



























 京公网安备 11010802027423号
京公网安备 11010802027423号