当前位置:
X-MOL 学术
›
J. Phys. Chem. A
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Modeling the OH-Initiated Oxidation of Mercury in the Global Atmosphere without Violating Physical Laws.
The Journal of Physical Chemistry A ( IF 2.9 ) Pub Date : 2020-01-06 , DOI: 10.1021/acs.jpca.9b10121 Theodore S Dibble 1 , Hanna L Tetu 1 , Yuge Jiao 1 , Colin P Thackray , Daniel J Jacob
The Journal of Physical Chemistry A ( IF 2.9 ) Pub Date : 2020-01-06 , DOI: 10.1021/acs.jpca.9b10121 Theodore S Dibble 1 , Hanna L Tetu 1 , Yuge Jiao 1 , Colin P Thackray , Daniel J Jacob
Affiliation
|
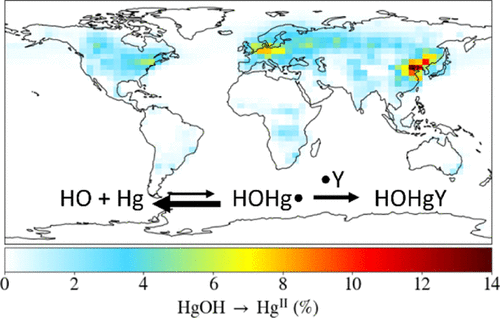
In 2005, Calvert and Lindberg (Calvert, J. G.; Lindberg, S. E. Atmos. Environ. 2005, 39, 3355-3367) wrote that the use of laboratory-derived rate constants for OH + Hg(0) "...to determine the extent of Hg removal by OH in the troposphere will greatly overestimate the importance of Hg removal by this reaction." The HOHg• intermediate formed from OH + Hg will mostly fall apart in the atmosphere before it can react. By contrast, in laboratory experiments, Calvert and Lindberg expected HOHg• to react with radicals (whose concentrations are much higher than in the atmosphere). Yet, almost all models of oxidation of Hg(0) ignore the argument of Calvert and Lindberg. We present a way for modelers to include the OH + Hg reaction while accounting quantitatively for the dissociation of HOHg•. We use high levels of quantum chemistry to establish the HO-Hg bond energy as 11.0 kcal/mol and calculate the equilibrium constant for OH + Hg = HOHg•. Using the measured rate constant for the association of OH with Hg, we determine the rate constant for HOHg• dissociation. Theory is also used to demonstrate that HOHg• forms stable compounds, HOHgY, with atmospheric radicals (Y = NO2, HOO•, CH3OO•, and BrO). We then present rate constants for use in modeling OH-initiated oxidation of Hg(0). We use this mechanism to model the global oxidation of Hg(0) in the period 2013-2015 using the GEOS-Chem 3D model of atmospheric chemistry. Because of the rapid dissociation of HOHg•, OH accounts for <1% of the global oxidation of Hg(0) to Hg(II), while Br atoms account for 97%.
中文翻译:

在不违反物理定律的情况下,模拟全球大气中OH引发的汞氧化。
2005年,Calvert和Lindberg(Calvert,JG; Lindberg,SE Atmos。Environ。2005,39,3355-3367)写道,使用实验室衍生的OH + Hg(0)速率常数“ ...确定对流层中OH去除Hg的程度将大大高估该反应去除Hg的重要性。” 由OH + Hg形成的HOHg•中间体在反应之前大部分会在大气中分解。相反,在实验室实验中,Calvert和Lindberg期望HOHg•与自由基(其浓度比大气中的浓度高得多)发生反应。但是,几乎所有的Hg(0)氧化模型都忽略了Calvert和Lindberg的观点。我们为建模人员提供了一种方法,使其包括OH + Hg反应,同时对HOHg•的解离进行了定量分析。我们使用高水平的量子化学方法将HO-Hg键能确定为11.0 kcal / mol,并计算OH + Hg = HOHg•的平衡常数。使用测得的OH与Hg缔合的速率常数,我们确定HOHg•离解的速率常数。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型对2013-2015年期间Hg(0)的全球氧化进行建模。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。0 kcal / mol并计算OH + Hg = HOHg•的平衡常数。使用测得的OH与Hg缔合的速率常数,我们确定HOHg•离解的速率常数。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。0 kcal / mol并计算OH + Hg = HOHg•的平衡常数。使用测得的OH与Hg缔合的速率常数,我们确定HOHg•离解的速率常数。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。
更新日期:2020-01-07
中文翻译:

在不违反物理定律的情况下,模拟全球大气中OH引发的汞氧化。
2005年,Calvert和Lindberg(Calvert,JG; Lindberg,SE Atmos。Environ。2005,39,3355-3367)写道,使用实验室衍生的OH + Hg(0)速率常数“ ...确定对流层中OH去除Hg的程度将大大高估该反应去除Hg的重要性。” 由OH + Hg形成的HOHg•中间体在反应之前大部分会在大气中分解。相反,在实验室实验中,Calvert和Lindberg期望HOHg•与自由基(其浓度比大气中的浓度高得多)发生反应。但是,几乎所有的Hg(0)氧化模型都忽略了Calvert和Lindberg的观点。我们为建模人员提供了一种方法,使其包括OH + Hg反应,同时对HOHg•的解离进行了定量分析。我们使用高水平的量子化学方法将HO-Hg键能确定为11.0 kcal / mol,并计算OH + Hg = HOHg•的平衡常数。使用测得的OH与Hg缔合的速率常数,我们确定HOHg•离解的速率常数。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型对2013-2015年期间Hg(0)的全球氧化进行建模。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。0 kcal / mol并计算OH + Hg = HOHg•的平衡常数。使用测得的OH与Hg缔合的速率常数,我们确定HOHg•离解的速率常数。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。0 kcal / mol并计算OH + Hg = HOHg•的平衡常数。使用测得的OH与Hg缔合的速率常数,我们确定HOHg•离解的速率常数。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。理论还用于证明HOHg•与大气自由基(Y = NO2,HOO•,CH3OO•和BrO)形成稳定的化合物HOHgY。然后,我们介绍了用于建模OH引发的Hg(0)氧化的速率常数。我们使用这一机制使用大气化学的GEOS-Chem 3D模型来模拟2013-2015年期间Hg(0)的全球氧化。由于HOHg•的快速分解,OH占Hg(0)到Hg(II)整体氧化的<1%,而Br原子占97%。



























 京公网安备 11010802027423号
京公网安备 11010802027423号