当前位置:
X-MOL 学术
›
BBA Biomembr.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
The membrane protein KCNQ1 potassium ion channel: Functional diversity and current structural insights.
Biochimica et Biophysica Acta (BBA) - Biomembranes ( IF 3.4 ) Pub Date : 2019-12-09 , DOI: 10.1016/j.bbamem.2019.183148 Gunjan Dixit 1 , Carole Dabney-Smith 1 , Gary A Lorigan 1
Biochimica et Biophysica Acta (BBA) - Biomembranes ( IF 3.4 ) Pub Date : 2019-12-09 , DOI: 10.1016/j.bbamem.2019.183148 Gunjan Dixit 1 , Carole Dabney-Smith 1 , Gary A Lorigan 1
Affiliation
|
BACKGROUND
Ion channels play crucial roles in cellular biology, physiology, and communication including sensory perception. Voltage-gated potassium (Kv) channels execute their function by sensor activation, pore-coupling, and pore opening leading to K+ conductance.
SCOPE OF REVIEW
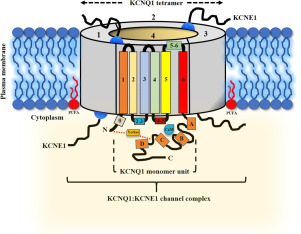
This review focuses on a voltage-gated K+ ion channel KCNQ1 (Kv 7.1). Firstly, discussing its positioning in the human ion chanome, and the role of KCNQ1 in the multitude of cellular processes. Next, we discuss the overall channel architecture and current structural insights on KCNQ1. Finally, the gating mechanism involving members of the KCNE family and its interaction with non-KCNE partners.
MAJOR CONCLUSIONS
KCNQ1 executes its important physiological functions via interacting with KCNE1 and non-KCNE1 proteins/molecules: calmodulin, PIP2, PKA. Although, KCNQ1 has been studied in great detail, several aspects of the channel structure and function still remain unexplored. This review emphasizes the structural and biophysical studies of KCNQ1, its interaction with KCNE1 and non-KCNE1 proteins and focuses on several seminal findings showing the role of VSD and the pore domain in the channel activation and gating properties.
GENERAL SIGNIFICANCE
KCNQ1 mutations can result in channel defects and lead to several diseases including atrial fibrillation and long QT syndrome. Therefore, a thorough structure-function understanding of this channel complex is essential to understand its role in both normal and disease biology. Moreover, unraveling the molecular mechanisms underlying the regulation of this channel complex will help to find therapeutic strategies for several diseases.
中文翻译:

膜蛋白KCNQ1钾离子通道:功能多样性和当前的结构见解。
背景技术离子通道在细胞生物学,生理学和包括感觉知觉的通信中起关键作用。电压门控钾(Kv)通道通过传感器激活,孔耦合和开孔导致K +电导来执行其功能。审查的范围这项审查的重点是电压门控K +离子通道KCNQ1(Kv 7.1)。首先,讨论其在人类离子力学中的定位,以及KCNQ1在众多细胞过程中的作用。接下来,我们讨论有关KCNQ1的总体渠道架构和当前的结构见解。最后,涉及KCNE家族成员的门控机制及其与非KCNE合作伙伴的互动。主要结论KCNQ1通过与KCNE1和非KCNE1蛋白/分子(钙调蛋白,PIP2和PKA)相互作用来执行其重要的生理功能。虽然,已经对KCNQ1进行了详细的研究,但仍未探索通道结构和功能的几个方面。这篇综述强调了KCNQ1的结构和生物物理研究,其与KCNE1和非KCNE1蛋白质的相互作用,并着重于几个开创性的发现,这些发现显示了VSD和孔结构域在通道激活和门控特性中的作用。一般意义KCNQ1突变可导致通道缺陷并导致多种疾病,包括心房颤动和长QT综合征。因此,对这种通道复合物的结构-功能的全面了解对于理解其在正常生物学和疾病生物学中的作用至关重要。此外,揭示该通道复合物调控的分子机制将有助于寻找多种疾病的治疗策略。通道结构和功能的几个方面仍待探索。这篇综述强调了KCNQ1的结构和生物物理研究,其与KCNE1和非KCNE1蛋白的相互作用,并着重于几个开创性的发现,这些发现显示了VSD和孔结构域在通道激活和门控特性中的作用。一般意义KCNQ1突变可导致通道缺陷并导致多种疾病,包括心房颤动和长QT综合征。因此,对这种通道复合物的结构-功能的透彻理解对于理解其在正常生物学和疾病生物学中的作用至关重要。此外,揭示该通道复合物调控的分子机制将有助于寻找多种疾病的治疗策略。通道结构和功能的几个方面仍待探索。这篇综述强调了KCNQ1的结构和生物物理研究,其与KCNE1和非KCNE1蛋白的相互作用,并着重于几个开创性的发现,这些发现显示了VSD和孔结构域在通道激活和门控特性中的作用。一般意义KCNQ1突变可导致通道缺陷并导致多种疾病,包括心房颤动和长QT综合征。因此,对这种通道复合物的结构功能的透彻理解对于理解其在正常生物学和疾病生物学中的作用至关重要。此外,揭示该通道复合物调控的分子机制将有助于寻找多种疾病的治疗策略。
更新日期:2019-12-09
中文翻译:

膜蛋白KCNQ1钾离子通道:功能多样性和当前的结构见解。
背景技术离子通道在细胞生物学,生理学和包括感觉知觉的通信中起关键作用。电压门控钾(Kv)通道通过传感器激活,孔耦合和开孔导致K +电导来执行其功能。审查的范围这项审查的重点是电压门控K +离子通道KCNQ1(Kv 7.1)。首先,讨论其在人类离子力学中的定位,以及KCNQ1在众多细胞过程中的作用。接下来,我们讨论有关KCNQ1的总体渠道架构和当前的结构见解。最后,涉及KCNE家族成员的门控机制及其与非KCNE合作伙伴的互动。主要结论KCNQ1通过与KCNE1和非KCNE1蛋白/分子(钙调蛋白,PIP2和PKA)相互作用来执行其重要的生理功能。虽然,已经对KCNQ1进行了详细的研究,但仍未探索通道结构和功能的几个方面。这篇综述强调了KCNQ1的结构和生物物理研究,其与KCNE1和非KCNE1蛋白质的相互作用,并着重于几个开创性的发现,这些发现显示了VSD和孔结构域在通道激活和门控特性中的作用。一般意义KCNQ1突变可导致通道缺陷并导致多种疾病,包括心房颤动和长QT综合征。因此,对这种通道复合物的结构-功能的全面了解对于理解其在正常生物学和疾病生物学中的作用至关重要。此外,揭示该通道复合物调控的分子机制将有助于寻找多种疾病的治疗策略。通道结构和功能的几个方面仍待探索。这篇综述强调了KCNQ1的结构和生物物理研究,其与KCNE1和非KCNE1蛋白的相互作用,并着重于几个开创性的发现,这些发现显示了VSD和孔结构域在通道激活和门控特性中的作用。一般意义KCNQ1突变可导致通道缺陷并导致多种疾病,包括心房颤动和长QT综合征。因此,对这种通道复合物的结构-功能的透彻理解对于理解其在正常生物学和疾病生物学中的作用至关重要。此外,揭示该通道复合物调控的分子机制将有助于寻找多种疾病的治疗策略。通道结构和功能的几个方面仍待探索。这篇综述强调了KCNQ1的结构和生物物理研究,其与KCNE1和非KCNE1蛋白的相互作用,并着重于几个开创性的发现,这些发现显示了VSD和孔结构域在通道激活和门控特性中的作用。一般意义KCNQ1突变可导致通道缺陷并导致多种疾病,包括心房颤动和长QT综合征。因此,对这种通道复合物的结构功能的透彻理解对于理解其在正常生物学和疾病生物学中的作用至关重要。此外,揭示该通道复合物调控的分子机制将有助于寻找多种疾病的治疗策略。


























 京公网安备 11010802027423号
京公网安备 11010802027423号