Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Aberrant granulosa cell-fate related to inactivated p53/Rb signaling contributes to granulosa cell tumors and to FOXL2 downregulation in the mouse ovary.
Oncogene ( IF 8 ) Pub Date : 2019-11-19 , DOI: 10.1038/s41388-019-1109-7 Victoria Cluzet 1 , Marie M Devillers 1 , Florence Petit 1 , Stéphanie Chauvin 1 , Charlotte M François 1 , Frank Giton 2 , Catherine Genestie 3 , Nathalie di Clemente 4 , Joëlle Cohen-Tannoudji 1 , Céline J Guigon 1, 5
Oncogene ( IF 8 ) Pub Date : 2019-11-19 , DOI: 10.1038/s41388-019-1109-7 Victoria Cluzet 1 , Marie M Devillers 1 , Florence Petit 1 , Stéphanie Chauvin 1 , Charlotte M François 1 , Frank Giton 2 , Catherine Genestie 3 , Nathalie di Clemente 4 , Joëlle Cohen-Tannoudji 1 , Céline J Guigon 1, 5
Affiliation
|
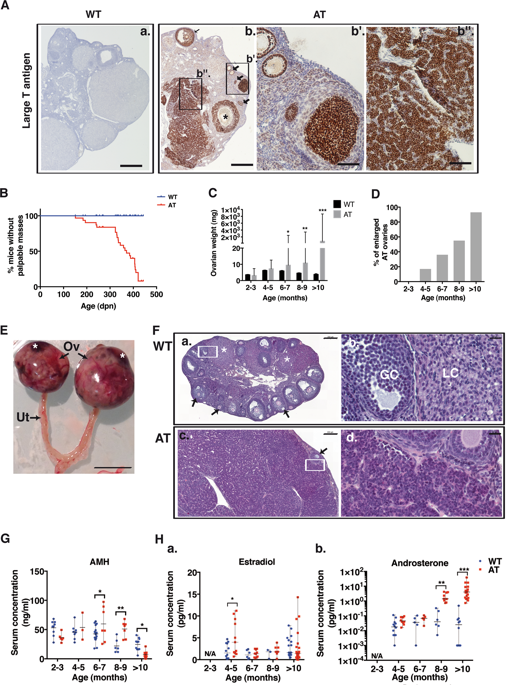
Ovarian granulosa cell tumors (GCTs) are indolent tumors of the ovary affecting women at all ages and potentially displaying late recurrence. Even if there is still little information regarding the mechanisms involved in GCT development and progression, FOXL2 would be a major tumor suppressor gene in granulosa cells. We analyzed the mechanisms underlying GCT initiation and progression by using mice with targeted expression of SV40 large T-antigen in granulosa cells (AT mouse), which develop GCTs. Consistent with patients, AT mice with developing GCTs displayed increased levels in circulating anti-Müllerian hormone (AMH), estradiol and androgens, as well as decreased FOXL2 protein abundance. Very few mice developed metastases (1 out of 30). In situ analyses revealed that GCT initiation resulted from both increased granulosa cell survival and proliferation in large antral follicles. Tumorigenesis was associated with the combined inactivation of p53 and Rb pathways, as shown by the impaired expression of respective downstream targets regulating cell apoptosis and proliferation, i.e., Bax, Bak, Gadd45a, Ccna2, Ccne1, E2f1, and Orc1. Importantly, the expression of FOXL2 was still present in newly developed GCTs and its downregulation only started during GCT growth. Collectively, our experiments provide evidence that disrupted p53/Rb signaling can drive tumor initiation and growth. This model challenges the current paradigm that impaired FOXL2 signaling is a major switch of granulosa cell tumorigenesis, albeit possibly contributing to tumor growth.
中文翻译:

与失活的 p53/Rb 信号传导相关的异常颗粒细胞命运有助于小鼠卵巢中的颗粒细胞肿瘤和 FOXL2 下调。
卵巢颗粒细胞瘤 (GCT) 是卵巢的惰性肿瘤,影响所有年龄段的女性,并可能表现出晚期复发。即使关于 GCT 发展和进展所涉及的机制的信息仍然很少,FOXL2 将是颗粒细胞中的主要肿瘤抑制基因。我们通过使用在颗粒细胞中靶向表达 SV40 大 T 抗原的小鼠(AT 小鼠)分析了 GCT 起始和进展的机制,这些小鼠产生了 GCT。与患者一致,患有 GCT 的 AT 小鼠表现出循环抗苗勒管激素 (AMH)、雌二醇和雄激素水平升高,以及 FOXL2 蛋白丰度降低。很少有小鼠发生转移(30 只中的 1 只)。原位分析表明,GCT 的启动是由于颗粒细胞存活率增加和大窦卵泡增殖所致。肿瘤发生与 p53 和 Rb 通路的联合失活有关,如调节细胞凋亡和增殖的各个下游靶标(即 Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1 和 Orc1)的受损表达所示。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。肿瘤发生与 p53 和 Rb 通路的联合失活有关,如调节细胞凋亡和增殖的各个下游靶标(即 Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1 和 Orc1)的受损表达所示。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。肿瘤发生与 p53 和 Rb 通路的联合失活有关,如调节细胞凋亡和增殖的各个下游靶标(即 Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1 和 Orc1)的受损表达所示。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。如调节细胞凋亡和增殖的各个下游靶标的表达受损所示,即Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1和Orc1。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。如调节细胞凋亡和增殖的各个下游靶标的表达受损所示,即Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1和Orc1。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。我们的实验提供的证据表明,p53/Rb 信号的中断可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。我们的实验提供的证据表明,p53/Rb 信号的中断可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。
更新日期:2019-11-20
中文翻译:

与失活的 p53/Rb 信号传导相关的异常颗粒细胞命运有助于小鼠卵巢中的颗粒细胞肿瘤和 FOXL2 下调。
卵巢颗粒细胞瘤 (GCT) 是卵巢的惰性肿瘤,影响所有年龄段的女性,并可能表现出晚期复发。即使关于 GCT 发展和进展所涉及的机制的信息仍然很少,FOXL2 将是颗粒细胞中的主要肿瘤抑制基因。我们通过使用在颗粒细胞中靶向表达 SV40 大 T 抗原的小鼠(AT 小鼠)分析了 GCT 起始和进展的机制,这些小鼠产生了 GCT。与患者一致,患有 GCT 的 AT 小鼠表现出循环抗苗勒管激素 (AMH)、雌二醇和雄激素水平升高,以及 FOXL2 蛋白丰度降低。很少有小鼠发生转移(30 只中的 1 只)。原位分析表明,GCT 的启动是由于颗粒细胞存活率增加和大窦卵泡增殖所致。肿瘤发生与 p53 和 Rb 通路的联合失活有关,如调节细胞凋亡和增殖的各个下游靶标(即 Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1 和 Orc1)的受损表达所示。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。肿瘤发生与 p53 和 Rb 通路的联合失活有关,如调节细胞凋亡和增殖的各个下游靶标(即 Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1 和 Orc1)的受损表达所示。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。肿瘤发生与 p53 和 Rb 通路的联合失活有关,如调节细胞凋亡和增殖的各个下游靶标(即 Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1 和 Orc1)的受损表达所示。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。如调节细胞凋亡和增殖的各个下游靶标的表达受损所示,即Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1和Orc1。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。如调节细胞凋亡和增殖的各个下游靶标的表达受损所示,即Bax、Bak、Gadd45a、Ccna2、Ccne1、E2f1和Orc1。重要的是,FOXL2 的表达仍然存在于新开发的 GCT 中,其下调仅在 GCT 生长期间开始。总的来说,我们的实验提供的证据表明,破坏 p53/Rb 信号可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。我们的实验提供的证据表明,p53/Rb 信号的中断可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。我们的实验提供的证据表明,p53/Rb 信号的中断可以驱动肿瘤的发生和生长。该模型挑战了当前范式,即受损 FOXL2 信号传导是颗粒细胞肿瘤发生的主要转变,尽管可能有助于肿瘤生长。


























 京公网安备 11010802027423号
京公网安备 11010802027423号