Cellular and Molecular Gastroenterology and Hepatology ( IF 7.2 ) Pub Date : 2022-09-09 , DOI: 10.1016/j.jcmgh.2022.09.003 Sen Yuan 1 , Jiaqi Xu 1 , Min Wang 1 , Junsong Huang 2 , Shuangshuang Ma 2 , Yang Liu 1 , Yujia Ke 1 , Xianhuang Zeng 1 , Kangwei Wu 1 , Jingwen Wang 1 , Xuezhang Tian 1 , Dandan Zheng 1 , Tanzeel Yousaf 1 , Wajeeha Naz 1 , Junwei Sun 3 , Lang Chen 1 , Deyin Guo 4 , Mingxiong Guo 5 , Guihong Sun 6
|
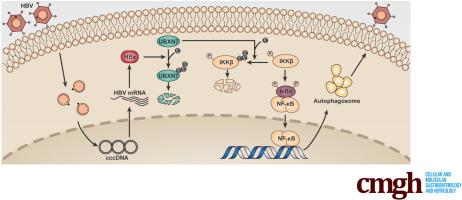
Chronic hepatitis B virus (HBV) infection is a leading cause of hepatocellular carcinoma. However, the function and mechanism of the effect of HBV on host protein ubiquitination remain largely unknown. We aimed at characterizing whether and how HBV promotes self-replication by affecting host protein ubiquitination. In this study, we identified UBXN7, a novel inhibitor for nuclear factor kappa B (NF-κB) signaling, was degraded via interaction with HBV X protein (HBx) to activate NF-κB signaling and autophagy, thereby affecting HBV replication. The expression of UBXN7 was analyzed by Western blot and quantitative reverse transcription polymerase chain reaction in HBV-transfected hepatoma cells and HBV-infected primary human hepatocytes (PHHs). The effects of UBXN7 on HBV replication were analyzed by using in vitro and in vivo assays, including stable isotope labeling by amino acids in cell culture (SILAC) analysis. Changes in HBV replication and the associated molecular mechanisms were analyzed in hepatoma cell lines. SILAC analyses showed that the ubiquitination of UBXN7 was significantly increased in HepG2.2.15 cells compared with control cells. After HBV infection, HBx protein interacted with UBXN7 to promote K48-linked ubiquitination of UBXN7 at K99, leading to UBXN7 degradation. On the other hand, UBXN7 interacted with the ULK domain of IκB kinase β through its ubiquitin-associating domain to facilitate its degradation. This in turn reduced NF-κB signaling, leading to reduced autophagy and consequently decreased HBV replication.
中文翻译:

HBV X 蛋白诱导 UBXN7 降解,一种新型的 NF-κB 信号负调节因子,促进 HBV 复制
慢性乙型肝炎病毒 (HBV) 感染是肝细胞癌的主要原因。然而,HBV 对宿主蛋白泛素化影响的功能和机制在很大程度上仍然未知。我们旨在描述 HBV 是否以及如何通过影响宿主蛋白泛素化来促进自我复制。在这项研究中,我们发现 UBXN7 是一种新型核因子 kappa B (NF-κB) 信号抑制剂,它通过与 HBV X 蛋白 (HBx) 的相互作用而被降解,从而激活 NF-κB 信号和自噬,从而影响 HBV 复制。在 HBV 转染的肝癌细胞和 HBV 感染的原代人肝细胞 (PHH) 中,通过蛋白质印迹和定量逆转录聚合酶链反应分析 UBXN7 的表达。使用体外和体内试验分析了 UBXN7 对 HBV 复制的影响,包括细胞培养 (SILAC) 分析中氨基酸的稳定同位素标记。在肝癌细胞系中分析了 HBV 复制的变化和相关的分子机制。SILAC 分析表明,与对照细胞相比,HepG2.2.15 细胞中 UBXN7 的泛素化显着增加。HBV 感染后,HBx 蛋白与 UBXN7 相互作用,促进 UBXN7 在 K99 位点的 K48 泛素化,导致 UBXN7 降解。另一方面,UBXN7 通过其泛素相关结构域与 IκB 激酶 β 的 ULK 结构域相互作用以促进其降解。这反过来又减少了 NF-κB 信号,导致自噬减少,从而减少了 HBV 复制。在肝癌细胞系中分析了 HBV 复制的变化和相关的分子机制。SILAC 分析表明,与对照细胞相比,HepG2.2.15 细胞中 UBXN7 的泛素化显着增加。HBV 感染后,HBx 蛋白与 UBXN7 相互作用,促进 UBXN7 在 K99 位点的 K48 泛素化,导致 UBXN7 降解。另一方面,UBXN7 通过其泛素相关结构域与 IκB 激酶 β 的 ULK 结构域相互作用以促进其降解。这反过来又减少了 NF-κB 信号,导致自噬减少,从而减少了 HBV 复制。在肝癌细胞系中分析了 HBV 复制的变化和相关的分子机制。SILAC 分析表明,与对照细胞相比,HepG2.2.15 细胞中 UBXN7 的泛素化显着增加。HBV 感染后,HBx 蛋白与 UBXN7 相互作用,促进 UBXN7 在 K99 位点的 K48 泛素化,导致 UBXN7 降解。另一方面,UBXN7 通过其泛素相关结构域与 IκB 激酶 β 的 ULK 结构域相互作用以促进其降解。这反过来又减少了 NF-κB 信号,导致自噬减少,从而减少了 HBV 复制。HBx 蛋白与 UBXN7 相互作用,促进 UBXN7 在 K99 处的 K48 泛素化,导致 UBXN7 降解。另一方面,UBXN7 通过其泛素相关结构域与 IκB 激酶 β 的 ULK 结构域相互作用以促进其降解。这反过来又减少了 NF-κB 信号,导致自噬减少,从而减少了 HBV 复制。HBx 蛋白与 UBXN7 相互作用,促进 UBXN7 在 K99 处的 K48 泛素化,导致 UBXN7 降解。另一方面,UBXN7 通过其泛素相关结构域与 IκB 激酶 β 的 ULK 结构域相互作用以促进其降解。这反过来又减少了 NF-κB 信号,导致自噬减少,从而减少了 HBV 复制。



























 京公网安备 11010802027423号
京公网安备 11010802027423号