Coordination Chemistry Reviews ( IF 20.6 ) Pub Date : 2021-09-21 , DOI: 10.1016/j.ccr.2021.214187 João P.L. Guerra 1 , João P. Jacinto 1 , Pedro Tavares 1
|
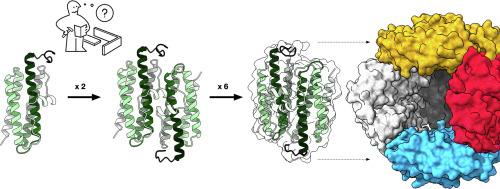
The subject of this review article was first reported approximately three decades ago upon the discovery of a starvation-inducible protein found tightly bound to chromosomal DNA in 3-day-old starved cultures of Escherichia coli. As a result, they were named “DNA-binding protein from starved cells” or Dps. Recognized by their homology to ferritins, these proteins were classified as a new branch of the Ferritin-like proteins superfamily and designated as miniferritins. These proteins present a cage-like structure built by twelve identical four-helix bundle monomers. They are capable of performing fast oxidation of ferrous ions using hydrogen peroxide, while still retaining the possibility of using molecular oxygen as co-substrate, and subsequently accumulating ferric ions in its cavity in a ferric mineral form. This complex catalytic activity is designed to protect cells from oxidative stress conditions, reducing the risk of harmful oxygen radical species being formed in particular physiological conditions. They are also capable of binding to and compacting DNA, becoming the most abundant nucleoid protein in the stationary phase, adding physical protection to the chemical protection attained by the ferroxidation reaction. Miniferritins are almost ubiquitous to Bacteria and Archaea, with protein characterization reported for over 60 microorganisms and several thousands of homologous genes annotated in current genomic databases, which demonstrates the importance of these proteins in Prokarya. In this manuscript we offer an extensive, yet concise, description of the state of the art on miniferritins, including their regulation, the global structural features, metal center characterization, diverse functional properties and the current stage of multifaceted biotechnological applications.
中文翻译:

微型铁蛋白:小型多功能蛋白质笼
这篇评论文章的主题大约在三年前首次报道,当时发现了一种饥饿诱导蛋白,该蛋白在 3 天大的大肠杆菌饥饿培养物中与染色体 DNA 紧密结合。. 因此,它们被命名为“来自饥饿细胞的 DNA 结合蛋白”或 Dps。由于它们与铁蛋白的同源性,这些蛋白质被归类为铁蛋白样蛋白超家族的一个新分支,并命名为微型铁蛋白。这些蛋白质呈现出由十二个相同的四螺旋束单体构建的笼状结构。它们能够使用过氧化氢对亚铁离子进行快速氧化,同时仍然保留使用分子氧作为共底物的可能性,并随后在其空腔中以三价铁矿物的形式积累三价铁离子。这种复杂的催化活性旨在保护细胞免受氧化应激条件的影响,降低在特定生理条件下形成有害氧自由基的风险。它们还能够结合和压缩 DNA,成为固定相中含量最多的类核蛋白,为亚铁氧化反应获得的化学保护增加了物理保护。微铁蛋白对于细菌和古细菌几乎无处不在,目前的基因组数据库中已经报道了超过 60 种微生物和数千个同源基因的蛋白质表征,这证明了这些蛋白质在 Prokarya 中的重要性。在这份手稿中,我们对微型铁蛋白的最新技术进行了广泛而简洁的描述,包括它们的调节、全局结构特征、金属中心表征、多样化的功能特性和多方面生物技术应用的当前阶段。在通过亚铁氧化反应获得的化学保护基础上增加物理保护。微铁蛋白对于细菌和古细菌几乎无处不在,目前的基因组数据库中已经报道了超过 60 种微生物和数千个同源基因的蛋白质表征,这证明了这些蛋白质在 Prokarya 中的重要性。在这份手稿中,我们对微型铁蛋白的最新技术进行了广泛而简洁的描述,包括它们的调节、全局结构特征、金属中心表征、多样化的功能特性和多方面生物技术应用的当前阶段。在通过亚铁氧化反应获得的化学保护基础上增加物理保护。微铁蛋白对于细菌和古细菌几乎无处不在,目前的基因组数据库中已经报道了超过 60 种微生物和数千个同源基因的蛋白质表征,这证明了这些蛋白质在 Prokarya 中的重要性。在这份手稿中,我们对微型铁蛋白的最新技术进行了广泛而简洁的描述,包括它们的调节、全局结构特征、金属中心表征、多样化的功能特性和多方面生物技术应用的当前阶段。报告了超过 60 种微生物的蛋白质表征和当前基因组数据库中注释的数千个同源基因,这证明了这些蛋白质在 Prokarya 中的重要性。在这份手稿中,我们对微型铁蛋白的最新技术进行了广泛而简洁的描述,包括它们的调节、全局结构特征、金属中心表征、多样化的功能特性和多方面生物技术应用的当前阶段。报告了超过 60 种微生物的蛋白质表征和当前基因组数据库中注释的数千个同源基因,这证明了这些蛋白质在 Prokarya 中的重要性。在这份手稿中,我们对微型铁蛋白的最新技术进行了广泛而简洁的描述,包括它们的调节、全局结构特征、金属中心表征、多样化的功能特性和多方面生物技术应用的当前阶段。



























 京公网安备 11010802027423号
京公网安备 11010802027423号