Journal of Molecular Graphics and Modelling ( IF 2.9 ) Pub Date : 2021-09-09 , DOI: 10.1016/j.jmgm.2021.108021 Saima Reyaz 1 , Alvea Tasneem 1 , Gyan Prakash Rai 1 , Hridoy R Bairagya 2
|
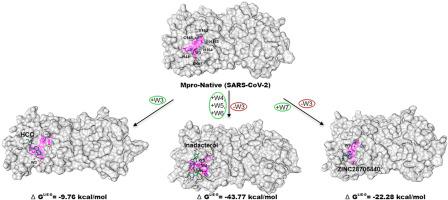
The main protease (Mpro) is the key enzyme of nCOVID-19 and plays a decisive role that makes it an attractive drug target. Multiple analysis of crystal structures reveals the presence of W1, W2, and W3 water locations in the active site pocket of Mpro; W1 and W2 are unstable and are weakly bonded with protein in comparison to W3 of Mpro-native. So, we adopt the water displacement method to occupy W1 or W2 sites by triggering HCQ or its analogs to inactivate the enzyme. Virtual screening is employed to find out best analogs of HCQ, molecular docking is used for water displacement from catalytic region of Mpro, and finally, MD simulations are conducted for validation of these findings. The docking study reveals that W1 and W2 are occupied by respective atoms of ZINC28706440 whereas W2 by HCQ and indacaterol. Finally, MD results demonstrate (i) HCQ occupies W1 and W2 positions, but its analogs (indacaterol and ZINC28706440) are inadequate to retain either W1 or W2 (ii) His41 and Asp187 are stabilized by W3 in Mpro-native and His41, Cys145 and HCQ by W7 in ZINC28706440, and W4, W5, and W6 make water mediated bridge between indacaterol with His41. The structural, dynamical, and thermodynamic (WFP and J value) profiling parameters suggest that W3, W4, and W7 are prominent in their corresponding positions in comparison with W5 and W6. The final results conclude that ZINC28706440 may act as a best analog of HCQ with acceptable physico-chemical and toxicological scores and may further be synthesized for experimental validation.
中文翻译:

SARS-CoV-2 主蛋白酶 (Mpro) 的羟氯喹结构类似物研究:计算药物发现研究
主要蛋白酶 (Mpro) 是 nCOVID-19 的关键酶,起着决定性作用,使其成为有吸引力的药物靶点。晶体结构的多重分析揭示了 Mpro 活性位点口袋中 W1、W2 和 W3 水位置的存在;与 Mpro-native 的 W3 相比,W1 和 W2 不稳定并且与蛋白质的结合较弱。因此,我们采用水置换法通过触发 HCQ 或其类似物使酶失活来占据 W1 或 W2 位点。虚拟筛选用于找出 HCQ 的最佳类似物,分子对接用于 Mpro 催化区域的水置换,最后,进行 MD 模拟以验证这些发现。对接研究表明,W1 和 W2 分别被 ZINC28706440 的原子占据,而 W2 被 HCQ 和茚达特罗占据。最后,MD 结果表明 (i) HCQ 占据 W1 和 W2 位置,但其类似物(茚达特罗和 ZINC28706440)不足以保留 W1 或 W2 (ii) His41 和 Asp187 在 Mpro-native 中被 W3 稳定,His41、Cys145 和 HCQ 通过ZINC28706440 中的 W7 和 W4、W5 和 W6 在茚达特罗和 His41 之间建立水介导的桥梁。结构、动力学和热力学(WFP 和 J 值)分析参数表明,与 W5 和 W6 相比,W3、W4 和 W7 在其相应位置上更为突出。最终结果得出结论,ZINC28706440 可以作为 HCQ 的最佳类似物,具有可接受的物理化学和毒理学评分,并且可以进一步合成以用于实验验证。但其类似物(茚达特罗和 ZINC28706440)不足以保留 W1 或 W2 (ii) His41 和 Asp187 在 Mpro-native 中由 W3 稳定,在 ZINC28706440 中由 W7 稳定 His41、Cys145 和 HCQ,W4、W5 和 W6 生成水介导茚达特罗与 His41 之间的桥梁。结构、动力学和热力学(WFP 和 J 值)分析参数表明,与 W5 和 W6 相比,W3、W4 和 W7 在其相应位置上更为突出。最终结果得出结论,ZINC28706440 可以作为 HCQ 的最佳类似物,具有可接受的物理化学和毒理学评分,并且可以进一步合成以用于实验验证。但其类似物(茚达特罗和 ZINC28706440)不足以保留 W1 或 W2 (ii) His41 和 Asp187 在 Mpro-native 中由 W3 稳定,在 ZINC28706440 中由 W7 稳定 His41、Cys145 和 HCQ,W4、W5 和 W6 生成水介导茚达特罗与 His41 之间的桥梁。结构、动力学和热力学(WFP 和 J 值)分析参数表明,与 W5 和 W6 相比,W3、W4 和 W7 在其相应位置上更为突出。最终结果得出结论,ZINC28706440 可以作为 HCQ 的最佳类似物,具有可接受的物理化学和毒理学评分,并且可以进一步合成以用于实验验证。和热力学(WFP 和 J 值)分析参数表明,与 W5 和 W6 相比,W3、W4 和 W7 在其相应位置上是突出的。最终结果得出结论,ZINC28706440 可以作为 HCQ 的最佳类似物,具有可接受的物理化学和毒理学评分,并且可以进一步合成以用于实验验证。和热力学(WFP 和 J 值)分析参数表明,与 W5 和 W6 相比,W3、W4 和 W7 在其相应位置上是突出的。最终结果得出结论,ZINC28706440 可以作为 HCQ 的最佳类似物,具有可接受的物理化学和毒理学评分,并且可以进一步合成以用于实验验证。


























 京公网安备 11010802027423号
京公网安备 11010802027423号