Bioactive Materials ( IF 18.9 ) Pub Date : 2021-09-08 , DOI: 10.1016/j.bioactmat.2021.09.004 Yao Bin 1, 2, 3, 4 , Zhu Dongzhen 1, 2 , Cui Xiaoli 5 , Enhe Jirigala 6, 7 , Song Wei 1, 2 , Li Zhao 1, 2 , Hu Tian 1, 2, 8 , Zhu Ping 4 , Li Jianjun 1, 2 , Wang Yuzhen 1, 2 , Zhang Yijie 1, 2 , Fu Xiaobing 1, 2 , Huang Sha 1, 2
|
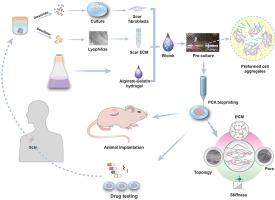
The therapeutic interventions of human hypertrophic scars (HHS) remain puzzle largely due to the lack of accepted models. Current HHS models are limited by their inability to mimic native scar architecture and associated pathological microenvironments. Here, we create a 3D functional HHS model by preformed cellular aggregates (PCA) bioprinting, firstly developing bioink from scar decellularized extracellular matrix (ECM) and alginate-gelatin (Alg-Gel) hydrogel with suitable physical properties to mimic the microenvironmental factors, then pre-culturing patient-derived fibroblasts in this bioink to preform the topographic cellular aggregates for sequent printing. We confirm the cell aggregates preformed in bioink displayed well defined aligned structure and formed functional scar tissue self-organization after bioprinting, hence showing the potential of creating HHS models. Notably, these HHS models exhibit characteristics of early-stage HHS in gene and protein expression, which significantly activated signaling pathway related to inflammation and cell proliferation, and recapitulate in vivo tissue dynamics of scar forming. We also use the in vitro and in vivo models to define the clinically observed effects to treatment with concurrent anti-scarring drugs, and the data show that it can be used to evaluate the potential therapeutic target for drug testing. The ideal humanized scar models we present should prove useful for studying critical mechanisms underlying HHS and to rapidly test new drug targets and develop patient-specific optimal therapeutic strategies in the future.
中文翻译:

用 3D 预成型细胞聚集体生物打印模拟人类肥厚性疤痕
由于缺乏公认的模型,人类肥厚性瘢痕 (HHS) 的治疗干预仍然令人困惑。当前的 HHS 模型受限于它们无法模拟天然疤痕结构和相关的病理微环境。在这里,我们通过预先形成的细胞聚集体 (PCA) 生物打印创建了一个 3D 功能 HHS 模型,首先从疤痕脱细胞细胞外基质 (ECM) 和海藻酸盐-明胶 (Alg-Gel) 水凝胶中开发具有合适物理特性的 bioink,以模拟微环境因素,然后在这种生物墨水中预培养患者来源的成纤维细胞,以预先形成用于后续打印的地形细胞聚集体。我们确认在 bioink 中预先形成的细胞聚集体显示出明确的排列结构,并在生物打印后形成功能性疤痕组织自组织,因此显示了创建 HHS 模型的潜力。值得注意的是,这些 HHS 模型在基因和蛋白质表达方面表现出早期 HHS 的特征,显着激活了与炎症和细胞增殖相关的信号通路,并概括了瘢痕形成的体内组织动力学。我们还使用体外和体内模型来定义临床观察到的并发抗瘢痕药物治疗的效果,数据表明它可用于评估药物测试的潜在治疗靶点。我们提出的理想人性化疤痕模型应该被证明有助于研究 HHS 的关键机制,并在未来快速测试新的药物靶点和开发针对患者的最佳治疗策略。这些 HHS 模型在基因和蛋白质表达方面表现出早期 HHS 的特征,显着激活了与炎症和细胞增殖相关的信号通路,并概括了瘢痕形成的体内组织动力学。我们还使用体外和体内模型来定义临床观察到的并发抗瘢痕药物治疗的效果,数据表明它可用于评估药物测试的潜在治疗靶点。我们提出的理想人性化疤痕模型应该被证明有助于研究 HHS 的关键机制,并在未来快速测试新的药物靶点和开发针对患者的最佳治疗策略。这些 HHS 模型在基因和蛋白质表达方面表现出早期 HHS 的特征,显着激活了与炎症和细胞增殖相关的信号通路,并概括了瘢痕形成的体内组织动力学。我们还使用体外和体内模型来定义临床观察到的并发抗瘢痕药物治疗的效果,数据表明它可用于评估药物测试的潜在治疗靶点。我们提出的理想人性化疤痕模型应该被证明有助于研究 HHS 的关键机制,并在未来快速测试新的药物靶点和开发针对患者的最佳治疗策略。并概括疤痕形成的体内组织动力学。我们还使用体外和体内模型来定义临床观察到的并发抗瘢痕药物治疗的效果,数据表明它可用于评估药物测试的潜在治疗靶点。我们提出的理想人性化疤痕模型应该被证明有助于研究 HHS 的关键机制,并在未来快速测试新的药物靶点和开发针对患者的最佳治疗策略。并概括疤痕形成的体内组织动力学。我们还使用体外和体内模型来定义临床观察到的并发抗瘢痕药物治疗的效果,数据表明它可用于评估药物测试的潜在治疗靶点。我们提出的理想人性化疤痕模型应该被证明有助于研究 HHS 的关键机制,并在未来快速测试新的药物靶点和开发针对患者的最佳治疗策略。



























 京公网安备 11010802027423号
京公网安备 11010802027423号