当前位置:
X-MOL 学术
›
J. Neurosci. Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Sigma‐2 receptor antagonists rescue neuronal dysfunction induced by Parkinson’s patient brain‐derived α‐synuclein
Journal of Neuroscience Research ( IF 4.2 ) Pub Date : 2021-01-22 , DOI: 10.1002/jnr.24782 Colleen S Limegrover 1 , Raymond Yurko 1 , Nicholas J Izzo 1 , Kelsie M LaBarbera 1 , Courtney Rehak 1 , Gary Look 1 , Gilbert Rishton 1 , Hank Safferstein 1 , Susan M Catalano 1
Journal of Neuroscience Research ( IF 4.2 ) Pub Date : 2021-01-22 , DOI: 10.1002/jnr.24782 Colleen S Limegrover 1 , Raymond Yurko 1 , Nicholas J Izzo 1 , Kelsie M LaBarbera 1 , Courtney Rehak 1 , Gary Look 1 , Gilbert Rishton 1 , Hank Safferstein 1 , Susan M Catalano 1
Affiliation
|
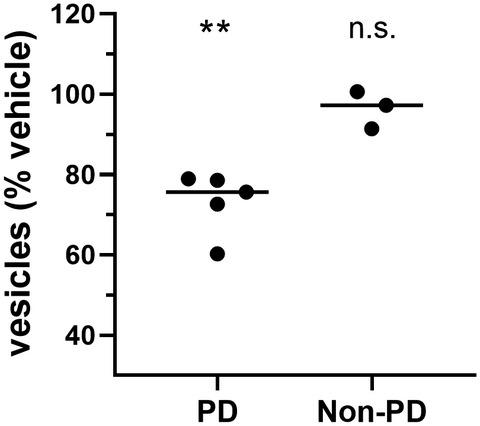
α‐Synuclein oligomers are thought to have a pivotal role in sporadic and familial Parkinson's disease (PD) and related α‐synucleinopathies, causing dysregulation of protein trafficking, autophagy/lysosomal function, and protein clearance, as well as synaptic function impairment underlying motor and cognitive symptoms of PD. Moreover, trans‐synaptic spread of α‐synuclein oligomers is hypothesized to mediate disease progression. Therapeutic approaches that effectively block α‐synuclein oligomer‐induced pathogenesis are urgently needed. Here, we show for the first time that α‐synuclein species isolated from human PD patient brain and recombinant α‐synuclein oligomers caused similar deficits in lipid vesicle trafficking rates in cultured rat neurons and glia, while α‐synuclein species isolated from non‐PD human control brain samples did not. Recombinant α‐synuclein oligomers also increased neuronal expression of lysosomal‐associated membrane protein‐2A (LAMP‐2A), the lysosomal receptor that has a critical role in chaperone‐mediated autophagy. Unbiased screening of several small molecule libraries (including the NIH Clinical Collection) identified sigma‐2 receptor antagonists as the most effective at blocking α‐synuclein oligomer‐induced trafficking deficits and LAMP‐2A upregulation in a dose‐dependent manner. These results indicate that antagonists of the sigma‐2 receptor complex may alleviate α‐synuclein oligomer‐induced neurotoxicity and are a novel therapeutic approach for disease modification in PD and related α‐synucleinopathies.
中文翻译:

Sigma-2 受体拮抗剂可挽救帕金森病患者脑源性 α-突触核蛋白诱导的神经元功能障碍
α-突触核蛋白寡聚体被认为在散发性和家族性帕金森病 (PD) 和相关的 α-突触核蛋白病中起关键作用,导致蛋白质运输、自噬/溶酶体功能和蛋白质清除的失调,以及运动和运动相关的突触功能障碍。 PD 的认知症状。此外,假设α-突触核蛋白寡聚体的跨突触传播介导疾病进展。迫切需要有效阻断 α-突触核蛋白寡聚体诱导的发病机制的治疗方法。在这里,我们首次表明从人 PD 患者大脑中分离出的 α-突触核蛋白和重组 α-突触核蛋白寡聚物在培养的大鼠神经元和神经胶质细胞中引起了类似的脂囊泡运输率缺陷,而从非 PD 中分离出的 α-突触核蛋白人类对照大脑样本没有。重组α-突触核蛋白寡聚体还增加了溶酶体相关膜蛋白-2A(LAMP-2A)的神经元表达,溶酶体受体在分子伴侣介导的自噬中起关键作用。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。在分子伴侣介导的自噬中起关键作用的溶酶体受体。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。在分子伴侣介导的自噬中起关键作用的溶酶体受体。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。
更新日期:2021-02-21
中文翻译:

Sigma-2 受体拮抗剂可挽救帕金森病患者脑源性 α-突触核蛋白诱导的神经元功能障碍
α-突触核蛋白寡聚体被认为在散发性和家族性帕金森病 (PD) 和相关的 α-突触核蛋白病中起关键作用,导致蛋白质运输、自噬/溶酶体功能和蛋白质清除的失调,以及运动和运动相关的突触功能障碍。 PD 的认知症状。此外,假设α-突触核蛋白寡聚体的跨突触传播介导疾病进展。迫切需要有效阻断 α-突触核蛋白寡聚体诱导的发病机制的治疗方法。在这里,我们首次表明从人 PD 患者大脑中分离出的 α-突触核蛋白和重组 α-突触核蛋白寡聚物在培养的大鼠神经元和神经胶质细胞中引起了类似的脂囊泡运输率缺陷,而从非 PD 中分离出的 α-突触核蛋白人类对照大脑样本没有。重组α-突触核蛋白寡聚体还增加了溶酶体相关膜蛋白-2A(LAMP-2A)的神经元表达,溶酶体受体在分子伴侣介导的自噬中起关键作用。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。在分子伴侣介导的自噬中起关键作用的溶酶体受体。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。在分子伴侣介导的自噬中起关键作用的溶酶体受体。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。对几个小分子文库(包括 NIH 临床资料库)的无偏见筛选确定 sigma-2 受体拮抗剂是在以剂量依赖性方式阻断 α-突触核蛋白寡聚体诱导的运输缺陷和 LAMP-2A 上调方面最有效的。这些结果表明 sigma-2 受体复合物的拮抗剂可以减轻 α-突触核蛋白寡聚体诱导的神经毒性,是一种新的治疗 PD 疾病和相关α-突触核蛋白病的治疗方法。



























 京公网安备 11010802027423号
京公网安备 11010802027423号