当前位置:
X-MOL 学术
›
J. Cell. Physiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Rspo1–LGR4 axis in BMSCs protects bone against radiation‐induced injury through the mTOR‐dependent autophagy pathway
Journal of Cellular Physiology ( IF 5.6 ) Pub Date : 2021-01-16 , DOI: 10.1002/jcp.30051 Xiaodan Chen 1, 2, 3 , Lingling Chen 1, 2, 3 , Jiali Tan 1, 2, 3 , Liping Zhang 4 , Juan Xia 1, 2, 3 , Bin Cheng 1, 2, 3 , Weizhen Zhang 4, 5
Journal of Cellular Physiology ( IF 5.6 ) Pub Date : 2021-01-16 , DOI: 10.1002/jcp.30051 Xiaodan Chen 1, 2, 3 , Lingling Chen 1, 2, 3 , Jiali Tan 1, 2, 3 , Liping Zhang 4 , Juan Xia 1, 2, 3 , Bin Cheng 1, 2, 3 , Weizhen Zhang 4, 5
Affiliation
|
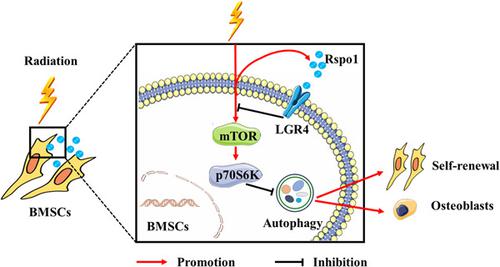
While mesenchymal stem cells (MSCs) have been widely used to repair radiation‐induced bone damage, the molecular mechanism underlying the effects of MSCs in the maintenance of bone homeostasis under radiation stress remains largely unknown. In this study, the role and mechanisms of R‐spondin 1 (Rspo1)–leucine‐rich repeat‐containing G protein‐coupled receptor 4 (LGR4) axis on the initiation of self‐defense of bone mesenchymal stem cells (BMSCs) and maintenance of bone homeostasis under radiation stress were investigated. Interestingly, radiation increased levels of Rspo1 and LGR4 in BMSCs. siRNA knockdown of Rspo1 or LGR4 aggravated radiation‐induced impairment of self‐renewal ability and osteogenic differentiation potential of BMSCs. However, exogenous Rspo1 significantly attenuated radiation‐induced depletion of BMSCs, and promoted the lineage shift towards osteoblasts. This alteration was associated with the reversal of mammalian target of rapamycin (mTOR) activation and autophagy decrement. Pharmacological and genetic blockade of autophagy attenuated the radio‐protective effects of Rspo1, rendering BMSCs more vulnerable to radiation‐induced injury. Then bone radiation injury was induced in C57BL6J mice to further determine the radio‐protective effects of Rspo1. In mice, administration of Rspo1 recombinant protein alleviated radiation‐induced bone loss. Our results uncover that Rspo1–LGR4–mTOR–autophagy axis are key mechanisms by which BMSCs initiate self‐defense against radiation and maintain bone homeostasis. Targeting Rspo1–LGR4 may provide a novel strategy for the intervention of radiation‐induced bone damage.
中文翻译:

BMSCs 中的 Rspo1-LGR4 轴通过 mTOR 依赖性自噬途径保护骨免受辐射损伤
虽然间充质干细胞 (MSCs) 已被广泛用于修复辐射诱导的骨损伤,但 MSCs 在辐射应激下维持骨稳态的分子机制仍然未知。在本研究中,R-spondin 1 (Rspo1)-富含亮氨酸重复序列的 G 蛋白偶联受体 4 (LGR4) 轴在骨间充质干细胞 (BMSCs) 自我防御启动和维持中的作用和机制研究了辐射应力下骨稳态的变化。有趣的是,辐射增加了 BMSC 中 Rspo1 和 LGR4 的水平。Rspo1 或 LGR4 的 siRNA 敲低加剧了辐射诱导的 BMSCs 自我更新能力和成骨分化潜能的损害。然而,外源性 Rspo1 显着减弱了辐射诱导的 BMSCs 耗竭,并促进了向成骨细胞的谱系转变。这种改变与哺乳动物雷帕霉素靶标 (mTOR) 激活和自噬减少的逆转有关。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。这种改变与哺乳动物雷帕霉素靶标 (mTOR) 激活和自噬减少的逆转有关。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。这种改变与哺乳动物雷帕霉素靶标 (mTOR) 激活和自噬减少的逆转有关。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。
更新日期:2021-03-23
中文翻译:

BMSCs 中的 Rspo1-LGR4 轴通过 mTOR 依赖性自噬途径保护骨免受辐射损伤
虽然间充质干细胞 (MSCs) 已被广泛用于修复辐射诱导的骨损伤,但 MSCs 在辐射应激下维持骨稳态的分子机制仍然未知。在本研究中,R-spondin 1 (Rspo1)-富含亮氨酸重复序列的 G 蛋白偶联受体 4 (LGR4) 轴在骨间充质干细胞 (BMSCs) 自我防御启动和维持中的作用和机制研究了辐射应力下骨稳态的变化。有趣的是,辐射增加了 BMSC 中 Rspo1 和 LGR4 的水平。Rspo1 或 LGR4 的 siRNA 敲低加剧了辐射诱导的 BMSCs 自我更新能力和成骨分化潜能的损害。然而,外源性 Rspo1 显着减弱了辐射诱导的 BMSCs 耗竭,并促进了向成骨细胞的谱系转变。这种改变与哺乳动物雷帕霉素靶标 (mTOR) 激活和自噬减少的逆转有关。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。这种改变与哺乳动物雷帕霉素靶标 (mTOR) 激活和自噬减少的逆转有关。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。这种改变与哺乳动物雷帕霉素靶标 (mTOR) 激活和自噬减少的逆转有关。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。自噬的药理学和基因阻断减弱了 Rspo1 的辐射保护作用,使 BMSCs 更容易受到辐射损伤。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。然后在 C57BL6J 小鼠中诱导骨辐射损伤,以进一步确定 Rspo1 的辐射防护作用。在小鼠中,Rspo1 重组蛋白的给药减轻了辐射诱导的骨质流失。我们的研究结果表明,Rspo1-LGR4-mTOR-自噬轴是 BMSCs 启动自我防御辐射和维持骨稳态的关键机制。靶向 Rspo1-LGR4 可能为干预辐射诱导的骨损伤提供一种新策略。


























 京公网安备 11010802027423号
京公网安备 11010802027423号