Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Proteasome interaction with ubiquitinated substrates: from mechanisms to therapies
The FEBS Journal ( IF 5.4 ) Pub Date : 2020-11-19 , DOI: 10.1111/febs.15638 Xiang Chen 1 , Zaw Min Htet 2 , Erika López-Alfonzo 2 , Andreas Martin 2, 3 , Kylie J Walters 1
The FEBS Journal ( IF 5.4 ) Pub Date : 2020-11-19 , DOI: 10.1111/febs.15638 Xiang Chen 1 , Zaw Min Htet 2 , Erika López-Alfonzo 2 , Andreas Martin 2, 3 , Kylie J Walters 1
Affiliation
|
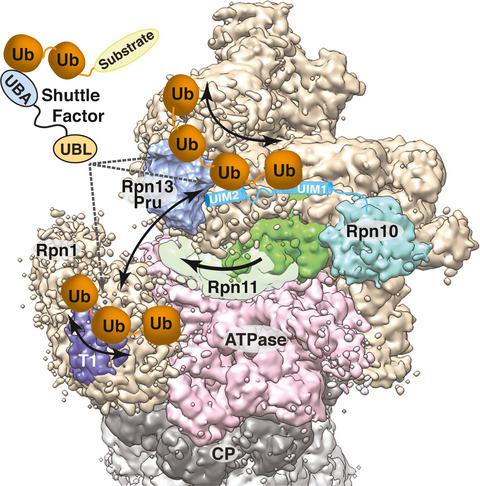
The 26S proteasome is responsible for regulated proteolysis in eukaryotic cells. Its substrates are diverse in structure, function, sequence length, and amino acid composition, and are targeted to the proteasome by post-translational modification with ubiquitin. Ubiquitination occurs through a complex enzymatic cascade and can also signal for other cellular events, unrelated to proteasome-catalyzed degradation. Like other post-translational protein modifications, ubiquitination is reversible, with ubiquitin chain hydrolysis catalyzed by the action of deubiquitinating enzymes (DUBs), ~ 90 of which exist in humans and allow for temporal events and dynamic ubiquitin-chain remodeling. DUBs have been known for decades to be an integral part of the proteasome, as deubiquitination is coupled to substrate unfolding and translocation into the internal degradation chamber. Moreover, the proteasome also binds several ubiquitinating enzymes and shuttle factors that recruit ubiquitinated substrates. The role of this intricate machinery and how ubiquitinated substrates interact with proteasomes remains an area of active investigation. Here, we review what has been learned about the mechanisms used by the proteasome to bind ubiquitinated substrates, substrate shuttle factors, ubiquitination machinery, and DUBs. We also discuss many open questions that require further study or the development of innovative approaches to be answered. Finally, we address the promise of expanded therapeutic targeting that could benefit from such new discoveries.
中文翻译:

蛋白酶体与泛素化底物的相互作用:从机制到治疗
26S 蛋白酶体负责调节真核细胞中的蛋白水解。其底物在结构、功能、序列长度和氨基酸组成方面具有多样性,并通过泛素的翻译后修饰靶向蛋白酶体。泛素化通过一个复杂的酶级联反应发生,也可以为其他细胞事件发出信号,与蛋白酶体催化的降解无关。与其他翻译后蛋白质修饰一样,泛素化是可逆的,泛素链水解由去泛素化酶 (DUB) 的作用催化,其中约 90 种酶存在于人类中,并允许时间事件和动态泛素链重塑。几十年来,人们都知道 DUB 是蛋白酶体的一个组成部分,因为去泛素化与底物展开和易位到内部降解室耦合。此外,蛋白酶体还结合了几种泛素化酶和穿梭因子,它们募集泛素化底物。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。蛋白酶体还结合了几种泛素化酶和穿梭因子,它们募集泛素化底物。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。蛋白酶体还结合了几种泛素化酶和穿梭因子,它们募集泛素化底物。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。
更新日期:2020-11-19
中文翻译:

蛋白酶体与泛素化底物的相互作用:从机制到治疗
26S 蛋白酶体负责调节真核细胞中的蛋白水解。其底物在结构、功能、序列长度和氨基酸组成方面具有多样性,并通过泛素的翻译后修饰靶向蛋白酶体。泛素化通过一个复杂的酶级联反应发生,也可以为其他细胞事件发出信号,与蛋白酶体催化的降解无关。与其他翻译后蛋白质修饰一样,泛素化是可逆的,泛素链水解由去泛素化酶 (DUB) 的作用催化,其中约 90 种酶存在于人类中,并允许时间事件和动态泛素链重塑。几十年来,人们都知道 DUB 是蛋白酶体的一个组成部分,因为去泛素化与底物展开和易位到内部降解室耦合。此外,蛋白酶体还结合了几种泛素化酶和穿梭因子,它们募集泛素化底物。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。蛋白酶体还结合了几种泛素化酶和穿梭因子,它们募集泛素化底物。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。蛋白酶体还结合了几种泛素化酶和穿梭因子,它们募集泛素化底物。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。这种复杂机制的作用以及泛素化底物如何与蛋白酶体相互作用仍然是一个积极研究的领域。在这里,我们回顾了关于蛋白酶体用于结合泛素化底物、底物穿梭因子、泛素化机制和 DUB 的机制的知识。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。我们还讨论了许多需要进一步研究或开发创新方法才能回答的开放性问题。最后,我们提出了可以从这些新发现中受益的扩大治疗靶向的承诺。



























 京公网安备 11010802027423号
京公网安备 11010802027423号