当前位置:
X-MOL 学术
›
J. Chem. Thermodyn.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Solubility determination and thermodynamic properties calculation of macitentan in mixtures of ethyl acetate and alcohols
The Journal of Chemical Thermodynamics ( IF 2.6 ) Pub Date : 2021-05-01 , DOI: 10.1016/j.jct.2020.106344 Rongrong Li , Yanxian Jin , Binbin Yu , Qianqian Xu , Xianlang Chen , Deman Han
The Journal of Chemical Thermodynamics ( IF 2.6 ) Pub Date : 2021-05-01 , DOI: 10.1016/j.jct.2020.106344 Rongrong Li , Yanxian Jin , Binbin Yu , Qianqian Xu , Xianlang Chen , Deman Han
|
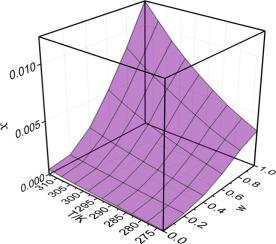
Abstract Due to macitentan (form I) is hydrophobic and has poor solubility, in this work, the solubility of macitentan in (methanol + ethyl acetate), (ethanol + ethyl acetate) and (isopropanol + ethyl acetate) was studied and correlated. In three mixed solvents, the solubility increased with the increase of temperature. In pure solvents, the largest mole solubility data was in ethyl acetate (1.223×10-2 at 313.15 K), followed by methanol (6.02×10-4 at 313.15 K), ethanol (4.58×10-4 at 313.15 K) and isopropanol (2.46×10-4 at 313.15 K). The solubility increased monotonically with the increase of ethyl acetate mass fraction at all studied temperatures. In mixtures of (ethyl acetate + methanol), the values varied from 6.02×10-4 to 1.223×10-2 at 313.15 K, an increase of 20.32 folds, meanwhile, 26.70 folds for mixtures of (ethanol + ethyl acetate) and 49.72 folds for mixtures of (isopropanol + ethyl acetate). The values of relative average deviations (RAD) in three systems with Jouyban-Acree model are 6.20%, 5.95% and 4.95%, respectively. For CNIBS/R-K model, the data is less than 5.0% at the temperature range from 273.15K to 293.15K only in mixture of (ethyl acetate + methanol). However, the data of Residual Sum of Squares (RSS) for Jouyban-Acree model and CNIBS/R-K model are 5.72 and 2.26, respectively. According to the result of analysis, the CNIBS/R-K model could provide a suitable prediction in three mixed solvents. In the following, the analysis of apparent thermodynamic properties for the dissolution processes indicate the dissolution process is not only endothermic but also entropy-driving .
中文翻译:

马西替坦在乙酸乙酯和醇类混合物中的溶解度测定和热力学性质计算
摘要 由于马西替坦(I型)疏水且溶解性差,本工作对马西替坦在(甲醇+乙酸乙酯)、(乙醇+乙酸乙酯)和(异丙醇+乙酸乙酯)中的溶解度进行了研究和关联。在三种混合溶剂中,溶解度随温度升高而增大。在纯溶剂中,最大摩尔溶解度数据是在乙酸乙酯中(1.223×10-2 在 313.15 K),其次是甲醇(6.02×10-4 在 313.15 K)、乙醇(4.58×10-4 在 313.15 K)和异丙醇(2.46×10-4 在 313.15 K)。在所有研究温度下,溶解度随着乙酸乙酯质量分数的增加而单调增加。在(乙酸乙酯+甲醇)混合物中,在313.15 K时值从6.02×10-4变化到1.223×10-2,增加了20.32倍,同时(乙醇+乙酸乙酯)和49的混合物增加了26.70倍. (异丙醇+乙酸乙酯)的混合物为72倍。Jouyban-Acree 模型的三个系统的相对平均偏差(RAD)值分别为 6.20%、5.95% 和 4.95%。对于 CNIBS/RK 模型,仅在(乙酸乙酯 + 甲醇)的混合物中,在 273.15K 至 293.15K 的温度范围内,数据小于 5.0%。然而,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。Jouyban-Acree 模型的三个系统的相对平均偏差(RAD)值分别为 6.20%、5.95% 和 4.95%。对于 CNIBS/RK 模型,仅在(乙酸乙酯 + 甲醇)混合物中,在 273.15K 至 293.15K 的温度范围内,数据小于 5.0%。但是,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面,对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。Jouyban-Acree 模型的三个系统的相对平均偏差(RAD)值分别为 6.20%、5.95% 和 4.95%。对于 CNIBS/RK 模型,仅在(乙酸乙酯 + 甲醇)混合物中,在 273.15K 至 293.15K 的温度范围内,数据小于 5.0%。然而,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。0% 在 273.15K 至 293.15K 的温度范围内,仅在(乙酸乙酯 + 甲醇)的混合物中。但是,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面,对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。0% 在 273.15K 至 293.15K 的温度范围内,仅在(乙酸乙酯 + 甲醇)的混合物中。然而,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。
更新日期:2021-05-01
中文翻译:

马西替坦在乙酸乙酯和醇类混合物中的溶解度测定和热力学性质计算
摘要 由于马西替坦(I型)疏水且溶解性差,本工作对马西替坦在(甲醇+乙酸乙酯)、(乙醇+乙酸乙酯)和(异丙醇+乙酸乙酯)中的溶解度进行了研究和关联。在三种混合溶剂中,溶解度随温度升高而增大。在纯溶剂中,最大摩尔溶解度数据是在乙酸乙酯中(1.223×10-2 在 313.15 K),其次是甲醇(6.02×10-4 在 313.15 K)、乙醇(4.58×10-4 在 313.15 K)和异丙醇(2.46×10-4 在 313.15 K)。在所有研究温度下,溶解度随着乙酸乙酯质量分数的增加而单调增加。在(乙酸乙酯+甲醇)混合物中,在313.15 K时值从6.02×10-4变化到1.223×10-2,增加了20.32倍,同时(乙醇+乙酸乙酯)和49的混合物增加了26.70倍. (异丙醇+乙酸乙酯)的混合物为72倍。Jouyban-Acree 模型的三个系统的相对平均偏差(RAD)值分别为 6.20%、5.95% 和 4.95%。对于 CNIBS/RK 模型,仅在(乙酸乙酯 + 甲醇)的混合物中,在 273.15K 至 293.15K 的温度范围内,数据小于 5.0%。然而,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。Jouyban-Acree 模型的三个系统的相对平均偏差(RAD)值分别为 6.20%、5.95% 和 4.95%。对于 CNIBS/RK 模型,仅在(乙酸乙酯 + 甲醇)混合物中,在 273.15K 至 293.15K 的温度范围内,数据小于 5.0%。但是,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面,对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。Jouyban-Acree 模型的三个系统的相对平均偏差(RAD)值分别为 6.20%、5.95% 和 4.95%。对于 CNIBS/RK 模型,仅在(乙酸乙酯 + 甲醇)混合物中,在 273.15K 至 293.15K 的温度范围内,数据小于 5.0%。然而,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。0% 在 273.15K 至 293.15K 的温度范围内,仅在(乙酸乙酯 + 甲醇)的混合物中。但是,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面,对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。0% 在 273.15K 至 293.15K 的温度范围内,仅在(乙酸乙酯 + 甲醇)的混合物中。然而,Jouyban-Acree 模型和 CNIBS/RK 模型的残差平方和 (RSS) 数据分别为 5.72 和 2.26。根据分析结果,CNIBS/RK 模型可以在三种混合溶剂中提供合适的预测。下面对溶解过程的表观热力学性质的分析表明,溶解过程不仅是吸热的,而且是熵驱动的。



























 京公网安备 11010802027423号
京公网安备 11010802027423号