Journal of Molecular Biology ( IF 5.6 ) Pub Date : 2020-10-15 , DOI: 10.1016/j.jmb.2020.10.015 Priyanka Dogra , Sourav Singha Roy , Ashish Joshi , Samrat Mukhopadhyay
|
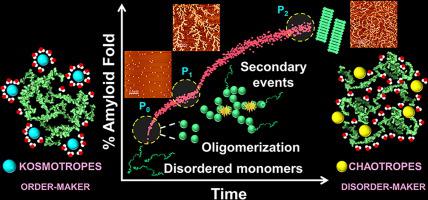
Hofmeister ions are thought to play fundamentally important roles in protein solubility, folding, stability, and function. Salt ions profoundly influence the course of protein misfolding, aggregation, and amyloid formation associated with devastating human diseases. However, the molecular origin of the salt-effect in protein aggregation remains elusive. Here, we report an unusual biphasic amyloidogenesis of a pH-responsive, intrinsically disordered, oligopeptide repeat domain of a melanosomal protein, Pmel17, that regulates the amyloid-assisted melanin synthesis in mammals via functional amyloid formation. We demonstrate that a symphony of molecular events involving charge-peptide interactions and hydration, in conjunction with secondary phenomena, critically governs the course of this biphasic amyloid assembly. We show that at mildly acidic pH, typical of melanosomes, highly amyloidogenic oligomeric units assemble into metastable, dendritic, fractal networks following the forward Hofmeister series. However, the subsequent condensation of fractal networks via conformational maturation into amyloid fibrils follows an inverse Hofmeister series due to fragmentation events coupled with secondary nucleation processes. Our results indicate that ions exert a strong influence on the aggregation kinetics as well as on the nanoscale morphology and also modulate the autocatalytic amplification processes during amyloid assembly via an intriguing dual Hofmeister effect. This unique interplay of molecular drivers will be of prime importance in delineating the aggregation pathways of a multitude of intrinsically disordered proteins involved in physiology and disease.
中文翻译:

Hofmeister离子通过异常的双相动力学调节固有紊乱的功能淀粉样蛋白域的自催化淀粉样蛋白生成。
霍夫迈斯特离子被认为在蛋白质溶解度,折叠,稳定性和功能方面起着根本性的作用。盐离子深刻影响与破坏性人类疾病相关的蛋白质错误折叠,聚集和淀粉样蛋白形成的过程。但是,蛋白质聚合中盐效应的分子起源仍然难以捉摸。在这里,我们报告了黑色素体蛋白Pmel17的pH响应,内在无序,寡肽重复结构域的异常双相淀粉样蛋白生成,该蛋白通过功能性淀粉样蛋白形成调节哺乳动物中淀粉样蛋白辅助的黑色素合成。我们证明,涉及电荷-肽相互作用和水合作用的分子事件的交响,再加上次级现象,严重控制了这种双相淀粉样蛋白组装的过程。我们表明在中等酸性的pH值下,典型的黑素体,高度淀粉样蛋白形成的寡聚单元按照正向Hofmeister系列组装成亚稳态的,树枝状的,分形的网络。然而,由于断裂事件和二次成核过程,随后通过构象成熟的分形网络缩合成淀粉样原纤维遵循霍夫迈斯特反序列。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。遵循前向Hofmeister系列,高度淀粉样蛋白形成的寡聚单元组装成亚稳态的树突状分形网络。然而,由于断裂事件和二次成核过程,随后通过构象成熟的分形网络缩合成淀粉样原纤维遵循霍夫迈斯特反序列。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。遵循前向Hofmeister系列,高度淀粉样蛋白形成的寡聚单元组装成亚稳态的树突状分形网络。然而,由于断裂事件和二次成核过程,随后通过构象成熟的分形网络缩合成淀粉样原纤维遵循霍夫迈斯特反序列。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。分形网络遵循正Hofmeister系列。然而,由于断裂事件和二次成核过程,随后通过构象成熟的分形网络缩合成淀粉样原纤维遵循霍夫迈斯特反序列。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。分形网络遵循正Hofmeister系列。然而,由于断裂事件和二次成核过程,随后通过构象成熟的分形网络缩合成淀粉样原纤维遵循霍夫迈斯特反序列。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。由于碎裂事件和二次成核过程,随后通过构象成熟的分形网络缩合成淀粉样原纤维遵循逆霍夫迈斯特系列。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。由于碎裂事件和二次成核过程,随后通过构象成熟的分形网络缩合成淀粉样原纤维遵循逆霍夫迈斯特系列。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。我们的结果表明,离子对聚集动力学以及纳米级形态具有强大影响,并且还通过有趣的双重Hofmeister效应调节淀粉样蛋白组装过程中的自催化扩增过程。分子驱动器的这种独特相互作用对于描述涉及生理学和疾病的多种内在无序蛋白的聚集途径至关重要。


























 京公网安备 11010802027423号
京公网安备 11010802027423号