当前位置:
X-MOL 学术
›
Chem. Rev.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Ion Dissociation in Ionic Liquids and Ionic Liquid Solutions
Chemical Reviews ( IF 62.1 ) Pub Date : 2020-10-07 , DOI: 10.1021/acs.chemrev.0c00373 Oscar Nordness 1 , Joan F. Brennecke 1
Chemical Reviews ( IF 62.1 ) Pub Date : 2020-10-07 , DOI: 10.1021/acs.chemrev.0c00373 Oscar Nordness 1 , Joan F. Brennecke 1
Affiliation
|
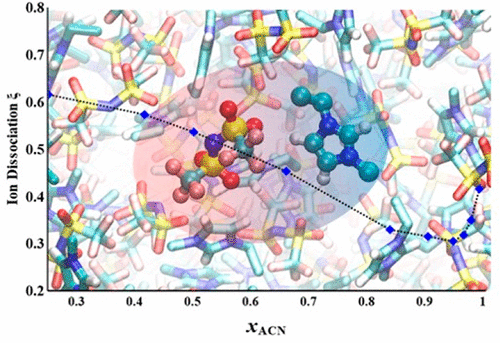
The extent to which cations and anions in ionic liquids (ILs) and ionic liquid solutions are dissociated is of both fundamental scientific interest and practical importance because ion dissociation has been shown to impact viscosity, density, surface tension, volatility, solubility, chemical reactivity, and many other important chemical and physical properties. When mixed with solvents, ionic liquids provide the unique opportunity to investigate ion dissociation from infinite dilution in the solvent to a completely solvent-free state, even at ambient conditions. The most common way to estimate ion dissociation in ILs and IL solutions is by comparing the molar conductivity determined from ionic conductivity measurements such as electrochemical impedance spectroscopy (EIS) (which measure the movement of only the charged, i.e., dissociated, ions) with the molar conductivity calculated from ion diffusivities measured by pulse field gradient nuclear magnetic resonance spectroscopy (PFG-NMR, which gives movement of all of the ions). Because the NMR measurements are time-consuming, the number of ILs and IL solutions investigated by this method is relatively limited. We have shown that use of the Stokes–Einstein equation with estimates of the effective ion Stokes radii allows ion dissociation to be calculated from easily measured density, viscosity, and ionic conductivity data (ρ, η, λ), which is readily available in the literature for a much larger number of pure ILs and IL solutions. Therefore, in this review, we present values of ion dissociation for ILs and IL solutions (aqueous and nonaqueous) determined by both the traditional molar conductivity/PFG-NMR method and the ρ, η, λ method. We explore the effect of cation and anion alkyl chain length, structure, and interaction motifs of the cation and anion, temperature, and the strength of the solvent in IL solutions.
中文翻译:

离子液体和离子液体溶液中的离子解离,离子液体和离子液体溶液中的离子解离,离子液体和离子液体溶液中的离子解离
离子液体(ILs)和离子液体溶液中阳离子和阴离子的离解程度具有根本的科学意义和实际重要性,因为已证明离子离解会影响粘度,密度,表面张力,挥发性,溶解度,化学反应性,以及许多其他重要的化学和物理性质。当与溶剂混合时,离子液体为研究从溶剂中无限稀释到完全无溶剂状态的离子解离提供了独特的机会,即使在环境条件下也是如此。估算IL和IL溶液中离子解离的最常用方法是比较由离子电导率测量(例如电化学阻抗谱(EIS))确定的摩尔电导率(仅测量带电的分子,即解离的 离子电导率的摩尔电导率是通过脉冲场梯度核磁共振波谱(PFG-NMR,给出所有离子的运动)测量的离子扩散率计算得出的。由于NMR测量非常耗时,因此通过这种方法研究的IL和IL溶液的数量相对有限。我们已经表明,通过使用斯托克斯-爱因斯坦方程式估算有效离子斯托克斯半径,可以根据易于测量的密度,粘度和离子电导率数据(ρ,η,λ)计算离子解离度,这在有关大量纯净IL和IL溶液的文献。因此,在本综述中,我们介绍了通过传统的摩尔电导率/ PFG-NMR方法以及ρ,η,IL和IL确定的IL和IL溶液(水性和非水性)的离子解离值 λ法。我们探讨了阳离子溶液和阴离子烷基链的长度,结构以及阳离子和阴离子的相互作用基序,温度以及IL溶液中溶剂强度的影响。,离子液体(ILs)和离子液体溶液中阳离子和阴离子的离解程度具有根本的科学意义和实际重要性,因为已证明离子离解会影响粘度,密度,表面张力,挥发性,溶解度,化学反应性,以及许多其他重要的化学和物理性质。当与溶剂混合时,离子液体为研究从溶剂中无限稀释到完全无溶剂状态的离子解离提供了独特的机会,即使在环境条件下也是如此。估算IL和IL溶液中离子解离的最常用方法是比较由离子电导率测量(例如电化学阻抗谱(EIS))确定的摩尔电导率(仅测量带电的分子,即解离的 离子电导率的摩尔电导率是通过脉冲场梯度核磁共振波谱(PFG-NMR,给出所有离子的运动)测量的离子扩散率计算得出的。由于NMR测量非常耗时,因此通过这种方法研究的IL和IL溶液的数量相对有限。我们已经表明,通过使用斯托克斯-爱因斯坦方程式估算有效离子斯托克斯半径,可以根据易于测量的密度,粘度和离子电导率数据(ρ,η,λ)计算离子解离度,这在有关大量纯净IL和IL溶液的文献。因此,在本综述中,我们介绍了通过传统的摩尔电导率/ PFG-NMR方法以及ρ,η,IL和IL确定的IL和IL溶液(水性和非水性)的离子解离值 λ法。我们探讨了阳离子溶液和阴离子烷基链的长度,结构以及阳离子和阴离子的相互作用基序,温度以及IL溶液中溶剂强度的影响。,离子液体(ILs)和离子液体溶液中阳离子和阴离子的离解程度具有根本的科学意义和实际重要性,因为已证明离子离解会影响粘度,密度,表面张力,挥发性,溶解度,化学反应性,以及许多其他重要的化学和物理性质。当与溶剂混合时,离子液体为研究从溶剂中无限稀释到完全无溶剂状态的离子解离提供了独特的机会,即使在环境条件下也是如此。估算IL和IL溶液中离子解离的最常用方法是比较由离子电导率测量(例如电化学阻抗谱(EIS))确定的摩尔电导率(仅测量带电的分子,即解离的 离子电导率的摩尔电导率是通过脉冲场梯度核磁共振波谱(PFG-NMR,给出所有离子的运动)测量的离子扩散率计算得出的。由于NMR测量非常耗时,因此通过这种方法研究的IL和IL溶液的数量相对有限。我们已经表明,通过使用斯托克斯-爱因斯坦方程式估算有效离子斯托克斯半径,可以根据易于测量的密度,粘度和离子电导率数据(ρ,η,λ)计算离子解离度,这在有关大量纯净IL和IL溶液的文献。因此,在本综述中,我们介绍了通过传统的摩尔电导率/ PFG-NMR方法以及ρ,η,IL和IL确定的IL和IL溶液(水性和非水性)的离子解离值 λ法。我们探讨了阳离子溶液和阴离子烷基链的长度,结构以及阳离子和阴离子的相互作用基序,温度以及IL溶液中溶剂强度的影响。
更新日期:2020-12-09
中文翻译:

离子液体和离子液体溶液中的离子解离,离子液体和离子液体溶液中的离子解离,离子液体和离子液体溶液中的离子解离
离子液体(ILs)和离子液体溶液中阳离子和阴离子的离解程度具有根本的科学意义和实际重要性,因为已证明离子离解会影响粘度,密度,表面张力,挥发性,溶解度,化学反应性,以及许多其他重要的化学和物理性质。当与溶剂混合时,离子液体为研究从溶剂中无限稀释到完全无溶剂状态的离子解离提供了独特的机会,即使在环境条件下也是如此。估算IL和IL溶液中离子解离的最常用方法是比较由离子电导率测量(例如电化学阻抗谱(EIS))确定的摩尔电导率(仅测量带电的分子,即解离的 离子电导率的摩尔电导率是通过脉冲场梯度核磁共振波谱(PFG-NMR,给出所有离子的运动)测量的离子扩散率计算得出的。由于NMR测量非常耗时,因此通过这种方法研究的IL和IL溶液的数量相对有限。我们已经表明,通过使用斯托克斯-爱因斯坦方程式估算有效离子斯托克斯半径,可以根据易于测量的密度,粘度和离子电导率数据(ρ,η,λ)计算离子解离度,这在有关大量纯净IL和IL溶液的文献。因此,在本综述中,我们介绍了通过传统的摩尔电导率/ PFG-NMR方法以及ρ,η,IL和IL确定的IL和IL溶液(水性和非水性)的离子解离值 λ法。我们探讨了阳离子溶液和阴离子烷基链的长度,结构以及阳离子和阴离子的相互作用基序,温度以及IL溶液中溶剂强度的影响。,离子液体(ILs)和离子液体溶液中阳离子和阴离子的离解程度具有根本的科学意义和实际重要性,因为已证明离子离解会影响粘度,密度,表面张力,挥发性,溶解度,化学反应性,以及许多其他重要的化学和物理性质。当与溶剂混合时,离子液体为研究从溶剂中无限稀释到完全无溶剂状态的离子解离提供了独特的机会,即使在环境条件下也是如此。估算IL和IL溶液中离子解离的最常用方法是比较由离子电导率测量(例如电化学阻抗谱(EIS))确定的摩尔电导率(仅测量带电的分子,即解离的 离子电导率的摩尔电导率是通过脉冲场梯度核磁共振波谱(PFG-NMR,给出所有离子的运动)测量的离子扩散率计算得出的。由于NMR测量非常耗时,因此通过这种方法研究的IL和IL溶液的数量相对有限。我们已经表明,通过使用斯托克斯-爱因斯坦方程式估算有效离子斯托克斯半径,可以根据易于测量的密度,粘度和离子电导率数据(ρ,η,λ)计算离子解离度,这在有关大量纯净IL和IL溶液的文献。因此,在本综述中,我们介绍了通过传统的摩尔电导率/ PFG-NMR方法以及ρ,η,IL和IL确定的IL和IL溶液(水性和非水性)的离子解离值 λ法。我们探讨了阳离子溶液和阴离子烷基链的长度,结构以及阳离子和阴离子的相互作用基序,温度以及IL溶液中溶剂强度的影响。,离子液体(ILs)和离子液体溶液中阳离子和阴离子的离解程度具有根本的科学意义和实际重要性,因为已证明离子离解会影响粘度,密度,表面张力,挥发性,溶解度,化学反应性,以及许多其他重要的化学和物理性质。当与溶剂混合时,离子液体为研究从溶剂中无限稀释到完全无溶剂状态的离子解离提供了独特的机会,即使在环境条件下也是如此。估算IL和IL溶液中离子解离的最常用方法是比较由离子电导率测量(例如电化学阻抗谱(EIS))确定的摩尔电导率(仅测量带电的分子,即解离的 离子电导率的摩尔电导率是通过脉冲场梯度核磁共振波谱(PFG-NMR,给出所有离子的运动)测量的离子扩散率计算得出的。由于NMR测量非常耗时,因此通过这种方法研究的IL和IL溶液的数量相对有限。我们已经表明,通过使用斯托克斯-爱因斯坦方程式估算有效离子斯托克斯半径,可以根据易于测量的密度,粘度和离子电导率数据(ρ,η,λ)计算离子解离度,这在有关大量纯净IL和IL溶液的文献。因此,在本综述中,我们介绍了通过传统的摩尔电导率/ PFG-NMR方法以及ρ,η,IL和IL确定的IL和IL溶液(水性和非水性)的离子解离值 λ法。我们探讨了阳离子溶液和阴离子烷基链的长度,结构以及阳离子和阴离子的相互作用基序,温度以及IL溶液中溶剂强度的影响。



























 京公网安备 11010802027423号
京公网安备 11010802027423号