当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Peptide-Based Approach to Inhibition of the Multidrug Resistance Efflux Pump AcrB
Biochemistry ( IF 2.9 ) Pub Date : 2020-10-07 , DOI: 10.1021/acs.biochem.0c00417 Joshua A Jesin 1, 2 , Tracy A Stone 1, 2 , Chloe J Mitchell 1, 2 , Eamonn Reading 3 , Charles M Deber 1, 2
Biochemistry ( IF 2.9 ) Pub Date : 2020-10-07 , DOI: 10.1021/acs.biochem.0c00417 Joshua A Jesin 1, 2 , Tracy A Stone 1, 2 , Chloe J Mitchell 1, 2 , Eamonn Reading 3 , Charles M Deber 1, 2
Affiliation
|
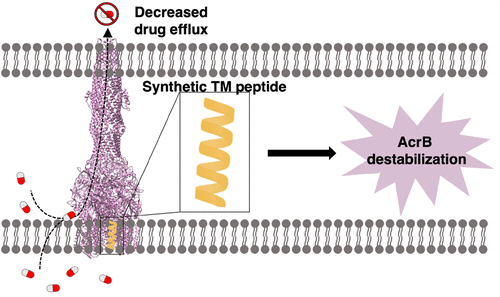
Clinically relevant multidrug-resistant bacteria often arise due to overproduction of membrane-embedded efflux proteins that are capable of pumping antibiotics out of the bacterial cell before the drugs can exert their intended toxic effect. The Escherichia coli membrane protein AcrB is the archetypal protein utilized for bacterial efflux study because it can extrude a diverse range of antibiotic substrates and has close homologues in many Gram-negative pathogens. Three AcrB subunits, each of which contains 12 transmembrane (TM) helices, are known to trimerize to form the minimal functional unit, stabilized noncovalently by helix–helix interactions between TM1 and TM8. To inhibit the efflux activity of AcrB, we have rationally designed synthetic peptides aimed at destabilizing the AcrB trimerization interface by outcompeting the subunit interaction sites within the membrane. Here we report that peptides mimicking TM1 or TM8, with flanking N-terminal peptoid tags, and C-terminal lysine tags that aid in directing the peptides to their membrane-embedded target, decrease the AcrB-mediated efflux of the fluorescent substrate Nile red and potentiate the effect of the antimicrobials chloramphenicol and ethidium bromide. To further characterize the motif encompassing the interaction between TM1 and TM8, we used Förster resonance energy transfer to demonstrate dimerization. Using the TM1 and TM8 peptides, in conjunction with several selected mutant peptides, we highlight residues that may increase the potency and specificity of the peptide drug candidates. In targeting membrane-embedded protein–protein interactions, this work represents a novel approach to AcrB inhibition and, more broadly, a potential route to a new category of efflux pump inhibitors.
中文翻译:

基于肽的多药耐药外排泵 AcrB 抑制方法
临床相关的多重耐药细菌通常是由于膜包埋外排蛋白的过量产生而产生的,这些外排蛋白能够在药物发挥其预期毒性作用之前将抗生素泵出细菌细胞。大肠杆菌_膜蛋白 AcrB 是用于细菌外排研究的原型蛋白,因为它可以挤出多种抗生素底物,并且在许多革兰氏阴性病原体中具有密切的同源物。已知三个 AcrB 亚基,每个亚基包含 12 个跨膜 (TM) 螺旋,它们会三聚化形成最小的功能单元,通过 TM1 和 TM8 之间的螺旋-螺旋相互作用非共价稳定。为了抑制 AcrB 的流出活性,我们合理地设计了合成肽,旨在通过竞争膜内的亚基相互作用位点来破坏 AcrB 三聚化界面的稳定性。在这里,我们报告了模拟 TM1 或 TM8 的肽,具有侧翼的 N 端类肽标签和 C 端赖氨酸标签,有助于将肽引导至其膜嵌入靶标,减少荧光底物尼罗红的 AcrB 介导的流出并增强抗菌剂氯霉素和溴化乙锭的作用。为了进一步表征包含 TM1 和 TM8 之间相互作用的基序,我们使用 Förster 共振能量转移来证明二聚化。使用 TM1 和 TM8 肽,连同几个选定的突变肽,我们突出显示可能增加肽候选药物效力和特异性的残基。在靶向膜包埋的蛋白质-蛋白质相互作用方面,这项工作代表了一种抑制 AcrB 的新方法,更广泛地说,是一种通往新型外排泵抑制剂的潜在途径。为了进一步表征包含 TM1 和 TM8 之间相互作用的基序,我们使用 Förster 共振能量转移来证明二聚化。使用 TM1 和 TM8 肽,连同几个选定的突变肽,我们突出显示可能增加肽候选药物效力和特异性的残基。在靶向膜包埋的蛋白质-蛋白质相互作用方面,这项工作代表了一种抑制 AcrB 的新方法,更广泛地说,是一种通往新型外排泵抑制剂的潜在途径。为了进一步表征包含 TM1 和 TM8 之间相互作用的基序,我们使用 Förster 共振能量转移来证明二聚化。使用 TM1 和 TM8 肽,连同几个选定的突变肽,我们突出显示可能增加肽候选药物效力和特异性的残基。在靶向膜包埋的蛋白质-蛋白质相互作用方面,这项工作代表了一种抑制 AcrB 的新方法,更广泛地说,是一种通往新型外排泵抑制剂的潜在途径。
更新日期:2020-10-21
中文翻译:

基于肽的多药耐药外排泵 AcrB 抑制方法
临床相关的多重耐药细菌通常是由于膜包埋外排蛋白的过量产生而产生的,这些外排蛋白能够在药物发挥其预期毒性作用之前将抗生素泵出细菌细胞。大肠杆菌_膜蛋白 AcrB 是用于细菌外排研究的原型蛋白,因为它可以挤出多种抗生素底物,并且在许多革兰氏阴性病原体中具有密切的同源物。已知三个 AcrB 亚基,每个亚基包含 12 个跨膜 (TM) 螺旋,它们会三聚化形成最小的功能单元,通过 TM1 和 TM8 之间的螺旋-螺旋相互作用非共价稳定。为了抑制 AcrB 的流出活性,我们合理地设计了合成肽,旨在通过竞争膜内的亚基相互作用位点来破坏 AcrB 三聚化界面的稳定性。在这里,我们报告了模拟 TM1 或 TM8 的肽,具有侧翼的 N 端类肽标签和 C 端赖氨酸标签,有助于将肽引导至其膜嵌入靶标,减少荧光底物尼罗红的 AcrB 介导的流出并增强抗菌剂氯霉素和溴化乙锭的作用。为了进一步表征包含 TM1 和 TM8 之间相互作用的基序,我们使用 Förster 共振能量转移来证明二聚化。使用 TM1 和 TM8 肽,连同几个选定的突变肽,我们突出显示可能增加肽候选药物效力和特异性的残基。在靶向膜包埋的蛋白质-蛋白质相互作用方面,这项工作代表了一种抑制 AcrB 的新方法,更广泛地说,是一种通往新型外排泵抑制剂的潜在途径。为了进一步表征包含 TM1 和 TM8 之间相互作用的基序,我们使用 Förster 共振能量转移来证明二聚化。使用 TM1 和 TM8 肽,连同几个选定的突变肽,我们突出显示可能增加肽候选药物效力和特异性的残基。在靶向膜包埋的蛋白质-蛋白质相互作用方面,这项工作代表了一种抑制 AcrB 的新方法,更广泛地说,是一种通往新型外排泵抑制剂的潜在途径。为了进一步表征包含 TM1 和 TM8 之间相互作用的基序,我们使用 Förster 共振能量转移来证明二聚化。使用 TM1 和 TM8 肽,连同几个选定的突变肽,我们突出显示可能增加肽候选药物效力和特异性的残基。在靶向膜包埋的蛋白质-蛋白质相互作用方面,这项工作代表了一种抑制 AcrB 的新方法,更广泛地说,是一种通往新型外排泵抑制剂的潜在途径。



























 京公网安备 11010802027423号
京公网安备 11010802027423号