当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Construction of Specific and Reversible Nanoreceptors for Proteins via Sequential Surface-Imprinting Strategy.
Analytical Chemistry ( IF 7.4 ) Pub Date : 2020-07-01 , DOI: 10.1021/acs.analchem.0c01366 Muhua Zhao 1 , Shan Huang 1 , Huaisyuan Xie 1 , Jiayu Wang 1 , Xiaoli Zhao 1 , Mengyuan Li 1 , Meiping Zhao 1
Analytical Chemistry ( IF 7.4 ) Pub Date : 2020-07-01 , DOI: 10.1021/acs.analchem.0c01366 Muhua Zhao 1 , Shan Huang 1 , Huaisyuan Xie 1 , Jiayu Wang 1 , Xiaoli Zhao 1 , Mengyuan Li 1 , Meiping Zhao 1
Affiliation
|
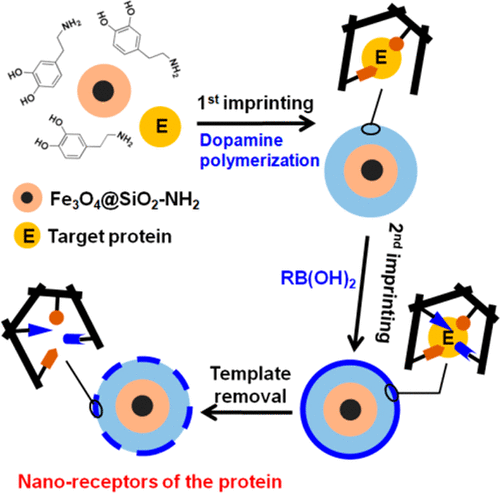
Molecular recognition of proteins is critical for study and manipulation of protein-related biological processes. However, design and synthesis of abiotic receptors for precise recognition of proteins still remains a challenging task. Herein, we developed a universal sequential surface-imprinting strategy that integrated two different types of imprinting reactions to construct artificial protein receptors with high selectivity. Employing dopamine self-polymerization and boronate/diol complexation as the first-step and second-step imprinting reactions, respectively, we synthesized surface-imprinted magnetic nanocomposites against two different enzyme proteins: deoxyribonuclease I (DNase I) and apurinic/apyrimidinic endonuclease/redox effector factor 1 (APE1). The obtained nanocomposites both showed strong and specific binding toward their respective template proteins. Moreover, the bound enzymes could be totally recovered with high activity under mild buffer conditions. These antibody-like specific and reversible binding properties enabled effective purification and enrichment of the low-abundance target proteins from complex serum samples. Compared to existing one-pot or one-step imprinting methods, the proposed sequential surface-imprinting approach offers a more flexible combination of different functional monomers and greatly enhances the performance and biocompatibility of the imprinted materials. The generality and simplicity of the sequential imprinting strategy would make it an appealing and competitive method to prepare artificial protein receptors.
中文翻译:

通过顺序表面印迹策略构建蛋白质的特异性和可逆纳米受体。
蛋白质的分子识别对于研究和操纵蛋白质相关的生物学过程至关重要。然而,用于精确识别蛋白质的非生物受体的设计和合成仍然是一项艰巨的任务。在这里,我们开发了一种通用的顺序表面印迹策略,该策略整合了两种不同类型的印迹反应,从而以高选择性构建了人工蛋白受体。分别采用多巴胺自聚合和硼酸酯/二醇络合作为第一步和第二步印迹反应,我们合成了针对两种不同酶蛋白的表面印迹磁性纳米复合材料:脱氧核糖核酸酶I(DNase I)和嘌呤/泛嘧啶核糖核酸内切酶/氧化还原效应因子1(APE1)。所获得的纳米复合材料均显示出对各自模板蛋白的强力和特异性结合。此外,在温和的缓冲液条件下,结合的酶可以高活性完全回收。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。在温和的缓冲液条件下,结合的酶可以高活性完全回收。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争性的方法。在温和的缓冲液条件下,结合的酶可以高活性完全回收。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争性的方法。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争性的方法。所提出的顺序表面压印方法提供了不同功能单体的更灵活组合,并大大提高了压印材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。所提出的顺序表面压印方法提供了不同功能单体的更灵活组合,并大大提高了压印材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。
更新日期:2020-08-04
中文翻译:

通过顺序表面印迹策略构建蛋白质的特异性和可逆纳米受体。
蛋白质的分子识别对于研究和操纵蛋白质相关的生物学过程至关重要。然而,用于精确识别蛋白质的非生物受体的设计和合成仍然是一项艰巨的任务。在这里,我们开发了一种通用的顺序表面印迹策略,该策略整合了两种不同类型的印迹反应,从而以高选择性构建了人工蛋白受体。分别采用多巴胺自聚合和硼酸酯/二醇络合作为第一步和第二步印迹反应,我们合成了针对两种不同酶蛋白的表面印迹磁性纳米复合材料:脱氧核糖核酸酶I(DNase I)和嘌呤/泛嘧啶核糖核酸内切酶/氧化还原效应因子1(APE1)。所获得的纳米复合材料均显示出对各自模板蛋白的强力和特异性结合。此外,在温和的缓冲液条件下,结合的酶可以高活性完全回收。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。在温和的缓冲液条件下,结合的酶可以高活性完全回收。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争性的方法。在温和的缓冲液条件下,结合的酶可以高活性完全回收。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争性的方法。这些类似抗体的特异性和可逆结合特性使得能够从复杂的血清样品中有效纯化和富集低丰度靶蛋白。与现有的一锅或一步印制方法相比,所提出的顺序表面印制方法可以更灵活地组合不同功能单体,并大大提高了被印制材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争性的方法。所提出的顺序表面压印方法提供了不同功能单体的更灵活组合,并大大提高了压印材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。所提出的顺序表面压印方法提供了不同功能单体的更灵活组合,并大大提高了压印材料的性能和生物相容性。顺序印迹策略的普遍性和简便性使其成为制备人工蛋白受体的一种有吸引力且具有竞争力的方法。

























 京公网安备 11010802027423号
京公网安备 11010802027423号