当前位置:
X-MOL 学术
›
ACS Synth. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Caged Activators of Artificial Allosteric Protein Biosensors.
ACS Synthetic Biology ( IF 4.7 ) Pub Date : 2020-04-27 , DOI: 10.1021/acssynbio.9b00500 Selvakumar Edwardraja 1 , Zhong Guo 2 , Jason Whitfield 1, 3 , Ignacio Retamal Lantadilla 1 , Wayne A Johnston 2 , Patricia Walden 2 , Claudia E Vickers 3, 4 , Kirill Alexandrov 2
ACS Synthetic Biology ( IF 4.7 ) Pub Date : 2020-04-27 , DOI: 10.1021/acssynbio.9b00500 Selvakumar Edwardraja 1 , Zhong Guo 2 , Jason Whitfield 1, 3 , Ignacio Retamal Lantadilla 1 , Wayne A Johnston 2 , Patricia Walden 2 , Claudia E Vickers 3, 4 , Kirill Alexandrov 2
Affiliation
|
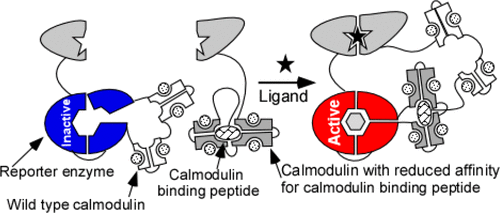
The ability of proteins to interconvert unrelated biochemical inputs and outputs underlays most energy and information processing in biology. A common conversion mechanism involves a conformational change of a protein receptor in response to a ligand binding or a covalent modification, leading to allosteric activity modulation of the effector domain. Designing such systems rationally is a central goal of synthetic biology and protein engineering. A two-component sensory system based on the scaffolding of modules in the presence of an analyte is one of the most generalizable biosensor architectures. An inherent problem of such systems is dependence of the response on the absolute and relative concentrations of the components. Here we use the example of two-component sensory systems based on calmodulin-operated synthetic switches to analyze and address this issue. We constructed “caged” versions of the activating domain thereby creating a thermodynamic barrier for spontaneous activation of the system. We demonstrate that the caged biosensor architectures could operate at concentrations spanning 3 orders of magnitude and are applicable to electrochemical, luminescent, and fluorescent two-component biosensors. We analyzed the activation kinetics of the caged biosensors and determined that the core allosteric switch is likely to be the rate limiting component of the system. These findings provide guidance for predictable engineering of robust sensory systems with inputs and outputs of choice.
中文翻译:

笼罩的人工变构蛋白生物传感器激活剂。
蛋白质相互转化无关的生化输入和输出的能力是生物学中大多数能量和信息处理的基础。常见的转化机制涉及响应配体结合或共价修饰的蛋白质受体的构象变化,从而导致效应域的变构活性调节。合理设计此类系统是合成生物学和蛋白质工程的主要目标。基于存在分析物的模块支架的两组分传感系统是最通用的生物传感器架构之一。这种系统的固有问题是响应依赖于组分的绝对浓度和相对浓度。在这里,我们以基于钙调蛋白操纵的合成开关的两组分感觉系统为例,分析并解决了这一问题。我们构建了激活域的“笼状”版本,从而为系统的自发激活创建了热力学屏障。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们构建了激活域的“笼状”版本,从而为系统的自发激活创建了热力学屏障。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们构建了激活域的“笼状”版本,从而为系统的自发激活创建了热力学屏障。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。
更新日期:2020-06-19
中文翻译:

笼罩的人工变构蛋白生物传感器激活剂。
蛋白质相互转化无关的生化输入和输出的能力是生物学中大多数能量和信息处理的基础。常见的转化机制涉及响应配体结合或共价修饰的蛋白质受体的构象变化,从而导致效应域的变构活性调节。合理设计此类系统是合成生物学和蛋白质工程的主要目标。基于存在分析物的模块支架的两组分传感系统是最通用的生物传感器架构之一。这种系统的固有问题是响应依赖于组分的绝对浓度和相对浓度。在这里,我们以基于钙调蛋白操纵的合成开关的两组分感觉系统为例,分析并解决了这一问题。我们构建了激活域的“笼状”版本,从而为系统的自发激活创建了热力学屏障。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们构建了激活域的“笼状”版本,从而为系统的自发激活创建了热力学屏障。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们构建了激活域的“笼状”版本,从而为系统的自发激活创建了热力学屏障。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。我们证明了笼状生物传感器架构可以在跨越3个数量级的浓度下运行,并且适用于电化学,发光和荧光二组分生物传感器。我们分析了笼状生物传感器的激活动力学,并确定核心变构开关很可能是系统的限速组件。这些发现为具有选择的输入和输出的鲁棒感官系统的可预测工程提供了指导。


























 京公网安备 11010802027423号
京公网安备 11010802027423号