当前位置:
X-MOL 学术
›
J. Mol. Cell. Cardiol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Distinct mechanisms mediate pacemaker dysfunction associated with catecholaminergic polymorphic ventricular tachycardia mutations: Insights from computational modeling.
Journal of Molecular and Cellular Cardiology ( IF 5 ) Pub Date : 2020-04-25 , DOI: 10.1016/j.yjmcc.2020.04.017 Limor Arbel-Ganon 1 , Joachim A Behar 1 , Ana María Gómez 2 , Yael Yaniv 1
Journal of Molecular and Cellular Cardiology ( IF 5 ) Pub Date : 2020-04-25 , DOI: 10.1016/j.yjmcc.2020.04.017 Limor Arbel-Ganon 1 , Joachim A Behar 1 , Ana María Gómez 2 , Yael Yaniv 1
Affiliation
|
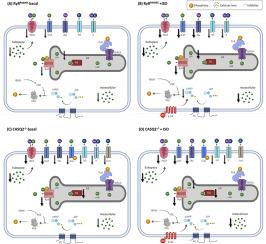
Catecholaminergic polymorphic ventricular tachycardia (CPVT) is a stress-induced ventricular arrhythmia associated with rhythm disturbance and impaired sinoatrial node cell (SANC) automaticity (pauses). Mutations associated with dysfunction of Ca2+-related mechanisms have been shown to be present in CPVT. These dysfunctions include impaired Ca2+ release from the ryanodine receptor (i.e., RyR2R4496C mutation) or binding to calsequestrin 2 (CASQ2). In SANC, Ca2+ signaling directly and indirectly mediates pacemaker function. We address here the following research questions: (i) what coupled-clock mechanisms and pathways mediate pacemaker mutations associated with CPVT in basal and in response to β-adrenergic stimulation? (ii) Can different mechanisms lead to the same CPVT-related pacemaker pauses? (iii) Can the mutation-induced deteriorations in SANC function be reversed by drug intervention or gene manipulation? We used a numerical model of mice SANC that includes membrane and intracellular mechanisms and their interconnected signaling pathways. In the basal state of RyR2R4496C SANC, the model predicted that the Na+-Ca2+ exchanger current (INCX) and T-type Ca2+ current (ICaT) mediate between changes in Ca2+ signaling and SANC dysfunction. Under β-adrenergic stimulation, changes in cAMP-PKA signaling and the sodium currents (INa), in addition to INCX and ICaT, mediate between changes in Ca2+ signaling and SANC automaticity pauses. Under basal conditions in Casq2-/-, the same mechanisms drove changes in Ca2+ signaling and subsequent pacemaker dysfunction. However, SANC automaticity pauses in response to β-AR stimulation were mediated by ICaT and INa. Taken together, distinct mechanisms can lead to CPVT-associated SANC automaticity pauses. In addition, we predict that specifically increasing SANC cAMP-PKA activity by either a pharmacological agent (IBMX, a phosphodiesterase (PDE) inhibitor), gene manipulation (overexpression of adenylyl cyclase 1/8) or direct manipulation of the SERCA phosphorylation target through changes in gene expression, compensate for the impairment in SANC automaticity. These findings suggest new insights for understanding CPVT and its therapeutic approach.
中文翻译:

不同的机制介导与儿茶酚胺能性多形性室性心动过速突变相关的起搏器功能障碍:计算模型的见解。
儿茶酚胺能性多形性室性心动过速(CPVT)是一种与心律失常和窦房结细胞(SANC)功能受损(暂停)相关的应激性心律失常。与CP2相关的Ca2 +相关机制功能障碍的突变已显示在CPVT中。这些功能障碍包括从莱诺丁碱受体释放的Ca2 +受损(即RyR2R4496C突变)或与钙网蛋白2(CASQ2)结合。在SANC中,Ca2 +信号直接或间接介导起搏器功能。我们在这里解决以下研究问题:(i)哪些耦合时钟机制和途径介导与基础和对β-肾上腺素能刺激相关的CPVT的起搏器突变?(ii)不同的机制能否导致相同的CPVT相关起搏器暂停?(iii)可以通过药物干预或基因操作来逆转由突变引起的SANC功能恶化吗?我们使用了小鼠SANC的数值模型,该模型包括膜和细胞内机制及其相互连接的信号通路。在RyR2R4496C SANC的基础状态下,该模型预测Na + -Ca2 +交换子电流(INCX)和T型Ca2 +电流(ICaT)在Ca2 +信号变化和SANC功能障碍之间介导。在β肾上腺素能刺激下,除了INCX和ICaT以外,cAMP-PKA信号和钠电流(INa)的变化,在Ca2 +信号变化和SANC自动暂停之间进行介导。在Casq2-/-的基础条件下,相同的机制推动了Ca2 +信号传导的变化以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。在Casq2-/-的基础条件下,相同的机制推动了Ca2 +信号传导的变化以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。在Casq2-/-的基础条件下,相同的机制推动了Ca2 +信号传导的变化以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。相同的机制推动了Ca2 +信号传导的改变以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。相同的机制推动了Ca2 +信号传导的改变以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。不同的机制可能导致CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。不同的机制可能导致CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。基因操纵(腺苷酸环化酶1/8的过表达)或通过基因表达的变化直接操纵SERCA磷酸化靶标,可以弥补SANC自动化的缺陷。这些发现为理解CPVT及其治疗方法提供了新的见解。基因操纵(腺苷酸环化酶1/8的过表达)或通过基因表达的变化直接操纵SERCA磷酸化靶标,可以弥补SANC自动化的缺陷。这些发现为理解CPVT及其治疗方法提供了新的见解。
更新日期:2020-04-25
中文翻译:

不同的机制介导与儿茶酚胺能性多形性室性心动过速突变相关的起搏器功能障碍:计算模型的见解。
儿茶酚胺能性多形性室性心动过速(CPVT)是一种与心律失常和窦房结细胞(SANC)功能受损(暂停)相关的应激性心律失常。与CP2相关的Ca2 +相关机制功能障碍的突变已显示在CPVT中。这些功能障碍包括从莱诺丁碱受体释放的Ca2 +受损(即RyR2R4496C突变)或与钙网蛋白2(CASQ2)结合。在SANC中,Ca2 +信号直接或间接介导起搏器功能。我们在这里解决以下研究问题:(i)哪些耦合时钟机制和途径介导与基础和对β-肾上腺素能刺激相关的CPVT的起搏器突变?(ii)不同的机制能否导致相同的CPVT相关起搏器暂停?(iii)可以通过药物干预或基因操作来逆转由突变引起的SANC功能恶化吗?我们使用了小鼠SANC的数值模型,该模型包括膜和细胞内机制及其相互连接的信号通路。在RyR2R4496C SANC的基础状态下,该模型预测Na + -Ca2 +交换子电流(INCX)和T型Ca2 +电流(ICaT)在Ca2 +信号变化和SANC功能障碍之间介导。在β肾上腺素能刺激下,除了INCX和ICaT以外,cAMP-PKA信号和钠电流(INa)的变化,在Ca2 +信号变化和SANC自动暂停之间进行介导。在Casq2-/-的基础条件下,相同的机制推动了Ca2 +信号传导的变化以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。在Casq2-/-的基础条件下,相同的机制推动了Ca2 +信号传导的变化以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。在Casq2-/-的基础条件下,相同的机制推动了Ca2 +信号传导的变化以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。相同的机制推动了Ca2 +信号传导的改变以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。相同的机制推动了Ca2 +信号传导的改变以及随后的起搏器功能障碍。但是,ICaT和INa介导了响应于β-AR刺激的SANC自动暂停。综上所述,不同的机制可能导致与CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。不同的机制可能导致CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。不同的机制可能导致CPVT相关的SANC自动暂停。此外,我们预测通过药理剂(IBMX,磷酸二酯酶(PDE)抑制剂),基因操纵(腺苷酸环化酶1/8的过表达)或通过变化直接控制SERCA磷酸化靶标,可以特异性提高SANC cAMP-PKA活性在基因表达中,补偿SANC自动化的损害。这些发现为理解CPVT及其治疗方法提供了新的见解。基因操纵(腺苷酸环化酶1/8的过表达)或通过基因表达的变化直接操纵SERCA磷酸化靶标,可以弥补SANC自动化的缺陷。这些发现为理解CPVT及其治疗方法提供了新的见解。基因操纵(腺苷酸环化酶1/8的过表达)或通过基因表达的变化直接操纵SERCA磷酸化靶标,可以弥补SANC自动化的缺陷。这些发现为理解CPVT及其治疗方法提供了新的见解。



























 京公网安备 11010802027423号
京公网安备 11010802027423号