当前位置:
X-MOL 学术
›
Chem. Bio. Drug Des.
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
Computational-based discovery of FAK FERM domain chemical probes that inhibit HER2-FAK cancer signaling.
Chemical Biology & Drug Design ( IF 3 ) Pub Date : 2020-02-20 , DOI: 10.1111/cbdd.13671 Erik Stahl 1 , Rohini Nott 1 , Karissa Koessel 2 , William Cance 1, 3, 4 , Timothy Marlowe 1, 3, 4, 5
Chemical Biology & Drug Design ( IF 3 ) Pub Date : 2020-02-20 , DOI: 10.1111/cbdd.13671 Erik Stahl 1 , Rohini Nott 1 , Karissa Koessel 2 , William Cance 1, 3, 4 , Timothy Marlowe 1, 3, 4, 5
Affiliation
|
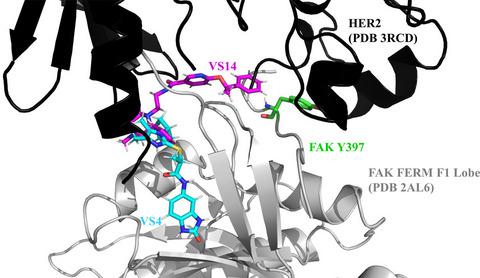
The N-terminal FERM domain of focal adhesion kinase (FAK) contributes to FAK scaffolding and interacts with HER2, an oncogene and receptor tyrosine kinase. The interaction between HER2 and FAK drives resistance to FAK-kinase domain inhibitors through FAK Y397 transphosphorylation and FAK re-activation upon inhibition. As such, FAK FERM remains an attractive drug discovery target. In this report, we detail an alternative approach to targeting FAK through virtual screening-based discovery of chemical probes that target FAK FERM. We validated the binding interface between HER2 and FAK using site-directed mutagenesis and GST pull-down experiments. We assessed the ligandability of key binding residues of HER2 and FAK utilizing computational tools. We developed a virtual screening method to screen approximately 200,000 compounds against the FAK FERM domain, identifying 20 chemical probes. We performed GST pull-down screening on these compounds, discovering two hits, VS4 and VS14, with nanomolar IC50 s in disrupting HER2-FAK. We performed further testing, including molecular docking, immunofluorescence, phosphorylation, and cellular invasion assays to evaluate the compounds' biological effects. One probe, VS14, was identified with the ability to block both auto- and trans-phosphorylation of Y397. In all, these studies identify two new probes that target FAK FERM, enabling future investigation of this domain.
中文翻译:

基于计算发现抑制 HER2-FAK 癌症信号传导的 FAK FERM 结构域化学探针。
粘着斑激酶 (FAK) 的 N 端 FERM 结构域有助于 FAK 支架并与 HER2(一种癌基因和受体酪氨酸激酶)相互作用。HER2 和 FAK 之间的相互作用通过 FAK Y397 转磷酸化和 FAK 在抑制后重新激活来驱动对 FAK 激酶结构域抑制剂的抗性。因此,FAK FERM 仍然是一个有吸引力的药物发现目标。在本报告中,我们详细介绍了一种通过基于虚拟筛选的以 FAK FERM 为目标的化学探针的发现来靶向 FAK 的替代方法。我们使用定点诱变和 GST 下拉实验验证了 HER2 和 FAK 之间的结合界面。我们利用计算工具评估了 HER2 和 FAK 的关键结合残基的配体能力。我们开发了一种虚拟筛选方法来筛选大约 200 个,针对 FAK FERM 结构域的 000 种化合物,识别 20 种化学探针。我们对这些化合物进行了 GST 下拉筛选,发现了两个命中,VS4 和 VS14,在破坏 HER2-FAK 时具有纳摩尔 IC50。我们进行了进一步的测试,包括分子对接、免疫荧光、磷酸化和细胞侵袭测定,以评估化合物的生物效应。一种探针 VS14 被鉴定为具有阻断 Y397 的自磷酸化和反式磷酸化的能力。总之,这些研究确定了两个针对 FAK FERM 的新探针,使未来能够对该领域进行调查。磷酸化和细胞侵袭测定以评估化合物的生物效应。一种探针 VS14 被鉴定为具有阻断 Y397 的自磷酸化和反式磷酸化的能力。总之,这些研究确定了两个针对 FAK FERM 的新探针,使未来能够对该领域进行调查。磷酸化和细胞侵袭测定以评估化合物的生物效应。一种探针 VS14 被鉴定为具有阻断 Y397 的自磷酸化和反式磷酸化的能力。总之,这些研究确定了两个针对 FAK FERM 的新探针,使未来能够对该领域进行调查。
更新日期:2020-02-20
中文翻译:

基于计算发现抑制 HER2-FAK 癌症信号传导的 FAK FERM 结构域化学探针。
粘着斑激酶 (FAK) 的 N 端 FERM 结构域有助于 FAK 支架并与 HER2(一种癌基因和受体酪氨酸激酶)相互作用。HER2 和 FAK 之间的相互作用通过 FAK Y397 转磷酸化和 FAK 在抑制后重新激活来驱动对 FAK 激酶结构域抑制剂的抗性。因此,FAK FERM 仍然是一个有吸引力的药物发现目标。在本报告中,我们详细介绍了一种通过基于虚拟筛选的以 FAK FERM 为目标的化学探针的发现来靶向 FAK 的替代方法。我们使用定点诱变和 GST 下拉实验验证了 HER2 和 FAK 之间的结合界面。我们利用计算工具评估了 HER2 和 FAK 的关键结合残基的配体能力。我们开发了一种虚拟筛选方法来筛选大约 200 个,针对 FAK FERM 结构域的 000 种化合物,识别 20 种化学探针。我们对这些化合物进行了 GST 下拉筛选,发现了两个命中,VS4 和 VS14,在破坏 HER2-FAK 时具有纳摩尔 IC50。我们进行了进一步的测试,包括分子对接、免疫荧光、磷酸化和细胞侵袭测定,以评估化合物的生物效应。一种探针 VS14 被鉴定为具有阻断 Y397 的自磷酸化和反式磷酸化的能力。总之,这些研究确定了两个针对 FAK FERM 的新探针,使未来能够对该领域进行调查。磷酸化和细胞侵袭测定以评估化合物的生物效应。一种探针 VS14 被鉴定为具有阻断 Y397 的自磷酸化和反式磷酸化的能力。总之,这些研究确定了两个针对 FAK FERM 的新探针,使未来能够对该领域进行调查。磷酸化和细胞侵袭测定以评估化合物的生物效应。一种探针 VS14 被鉴定为具有阻断 Y397 的自磷酸化和反式磷酸化的能力。总之,这些研究确定了两个针对 FAK FERM 的新探针,使未来能够对该领域进行调查。


























 京公网安备 11010802027423号
京公网安备 11010802027423号