JEV背靠背|清华大学尹航课题组报道外泌体在天然免疫信号通路中的调控机制
天然免疫是一种广泛存在于哺乳动物体内的非特异性免疫系统,是宿主抵御微生物入侵的第一道防线。天然免疫受体通过与来自病原体的配体相结合,发挥免疫响应以快速应对感染。这些信号通路的精准响应对于感染后的机体至关重要,激活异常将导致系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病,甚至脓毒症等严重威胁人类生命,因此天然免疫信号调控机制的研究及调控剂的开发对于疾病治疗十分重要。
细胞外囊泡(Extracellular Vesicles,EV),包括通常说的外泌体,是一种几乎所有细胞都会分泌的膜被小泡,可以携带核酸、蛋白质等生物活性物质,在抗微生物防御和过敏、自身免疫和抗肿瘤免疫反应等免疫过程中具有重要作用。近年来,人们认识到EVs具有作为生物标志物或治疗工具的潜力,其相关产业也蓬勃发展,在EV癌症早筛、载药、治疗等创新疗法等方面资本布局广泛,在神经疾病、罕见病等发病机制研究中也不断发布突破成果。
开发化学生物学新方法是研究EV生物学功能的重要手段,今年早些时候尹航教授课题组与清华大学化学系瑕瑜教授课题组合作,在Angew. Chem. Int. Ed.杂志上发表了题为“sn-1 Specificity of Lysophosphatidylcholine Acyltransferase-1 Revealed by a Mass Spectrometry-based Assay”的文章(DOI: 10.1002/anie.202215556),首次揭示磷脂酰胆碱酰基转移酶1(LPCAT1)在合成胆碱甘油磷脂(phosphatidylcholine,PC)时对甘油骨架的sn-1位置具有选择性;该选择性与LPACT1在人肝细胞癌组织中的高表达直接导致了sn位置异构体PC 18:1/16: 0的显著升高,实现基于质谱的高分辨率脂质异构体分析,为EV中脂质的生物学功能研究奠定基础。
2023年3月以来,尹航教授在国际细胞外囊泡协会(International Society of Extracellular Vesicle)旗舰期刊Journal of Extracellular Vesicles(5-year IF =22.603)上连续发表两篇文章,分别报道EVs在LPS/TLR4和cGAS/STING信号通路中的调控机制,提供了脂质和蛋白质调控EV生成的新机制,大大扩展了我们对EVs参与的天然免疫信号传递过程的了解。


题为“Exosomal lipid PI4P regulates small extracellular vesicle secretion by modulating intraluminal vesicle formation”的文章(DOI: 10.1002/jev2.12319),与瑕瑜教授合作,报道了磷脂酰肌醇(Phosphoinositolphosphates,PIP)在EVs中的含量及在天然免疫激活条件下的变化情况,并阐明了PIP在EV生成中分子机制。
研究发现在TLR4激活条件下,巨噬细胞内EVs释放速率随TLR4的配体革兰氏阴性细菌外部细胞壁的一种主要糖脂组分——脂多糖(Lipopolysaccharide,LPS)刺激时间先升高后降低,表现出明显的时间规律。通过与瑕瑜课题组合作,对EVs中微量磷脂PIP的定量检测,发现介导囊泡生成的PI4P与EVs的释放速率呈显著正相关关系,并进一步阐释PIP在EV生成与释放中的分子机制(图1)。
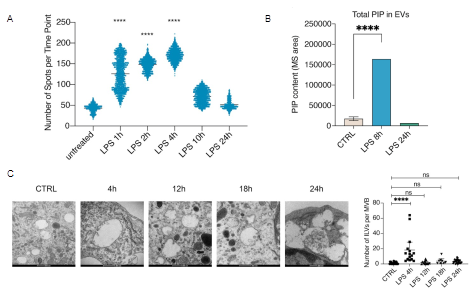
图1. LPS刺激调控EV释放速率变化及EV中PIP含量
在机制上,EV生成变化通过多囊泡体(MVB)上EV前体腔内囊泡(ILV)的数目变化来实现。TLR4天然免疫信号激活后,巨噬细胞内LPS-TLR4下游的TRIF信号通路激活产生I型干扰素,抑制PIP5K1C的表达,增加MVB上的PI4P含量,促进EV释放;刺激时间延长后,HSPA5表达增加,减少MVB上PI4P定位,EV释放减少(图2)。TLR4受体持续性激活所致的过度免疫反应是脓毒血症的主要诱因,EVs所参与的严格时序调控将有效避免信号的持续性激活。质谱作为脂质检测的高灵敏手段未来在EV等膜性细胞器的研究中将会发挥重要功能。
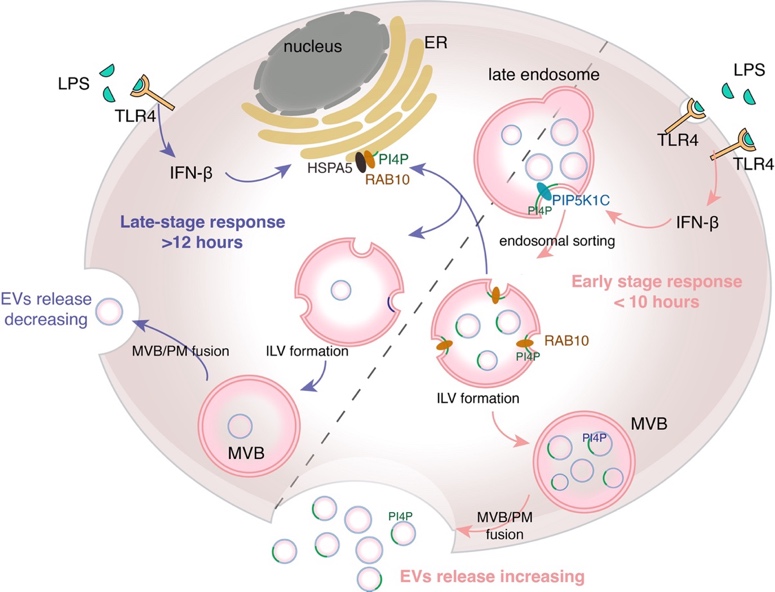
图2. LPS-TLR4 信号通路调节 EVs 释放的分子机制模式图
另一篇题为“STAM transports STING oligomers into extracellular vesicles, down-regulating the innate immune response”的研究(DOI: 10.1002/jev2.12316),报道了EV在另一种天然免疫DNA感受器cGAS/STING通路中的新机制。该通路中的重要元件STING蛋白在激活后,以寡聚体的形式进入EVs。研究鉴定到内吞体转运复合体(ESCRT)的元件STAM蛋白能够结合STING的寡聚体,并将其转运到EVs中。该研究表明STAM负调控STING信号通路,说明了STAM协助STING进入EVs并被降解的过程,是一种STING在激活后的适时终止,达到精准调控的机制(图3)。

图3. STAM协助STING寡聚体进入EVs,防止STING信号通路过度激活
研究者通过超速离心的方法分离得到了STING信号通路激活后的细胞分泌产生的EV,结合生化实验验证,确认了STING在激活后能够通过多囊泡体途径进入EVs(图4左),通过非变性凝胶电泳确认了EVs中的STING是以寡聚体的形式存在(图4右)。进一步的,通过构建了一系列稳定敲降基因的细胞系,研究者筛选得到了ESCRT中的元件STAM能够协助STING的寡聚体进入EVs。而进一步生化实验说明,STING在激活后形成的寡聚体能够与STAM发生直接结合,并使STAM发生诱导表达。

图4. STING在激活后以寡聚体形式分泌进入EVs。左:STING在激活后能够通过多囊泡体途径进入EVs;右:EVs中的STING是以寡聚体的形式存在
在阐明现象和机制后,研究者开始研究其中的生物学功能。通过一系列的细胞生物学工具,研究者发现,EVs中的STING几乎全部与受体细胞的溶酶体共定位,说明STING进入EVs最终可能被受体细胞的溶酶体所降解。而细胞水平的生化检测也说明STAM能够负调控STING信号通路。这就说明了STAM协助STING进入EVs并被降解的过程,是一种STING在激活后的适时终止,达到精准调控的机制。
近年来,由于EV可以实现液体活检、载药以及可透过血脑屏障等优势,该领域的研究持续升温。该两项研究为天然免疫中EV参与的信号传递提供新机制,为疾病的发病机理提供新解释。同时,结合化学生物学、分析化学的交叉学科研究也为生物学机制的探索提供有效参考途径。
以上两项成果,清华大学药学院尹航教授为通讯作者,北京大学前沿交叉学科研究院PTN项目2023届博士生靳学为PI4P相关论文第一作者,清华大学化学系2023届博士生梁家琦为STING相关论文第一作者。感谢国家自然科学基金委、国家科技部重点研发计划、北京市教委提供的经费支持。
导师介绍
尹航
https://www.x-mol.com/university/faculty/46697
瑕瑜
https://www.x-mol.com/university/faculty/49795
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号