Angew. Chem.:钯催化等键不对称C–H键碘化反应
C–H键活化反应的原子和步骤经济性等优点,发展不对称C–H键碘化反应的新策略是非常值得探索的领域。然而虽然C–H键卤化反应已经有很多报道,不对称C–H键卤化反应却非常有限。手性碘化物在药物、天然产物、手性配体、手性试剂以及催化剂等领域应用广泛。手性碘化物的不对称构建受到了化学家们的广泛关注,但不对称C–H键碘化反应目前还非常稀少。另一方面,等键反应由于往往能够使用友好温和的反应试剂而受到青睐,但不对称等键C–H键活化反应目前还没有报道(图1),是一个挑战性的难题(等键反应的IUPAC定义:反应物中断裂的化学键类型和产物中新形成的化学键类型是一样的化学反应)。此外,苯乙酸是很多日常药物的重要骨架,因此其C–H键活化反应的研究具有重要的研究价值。
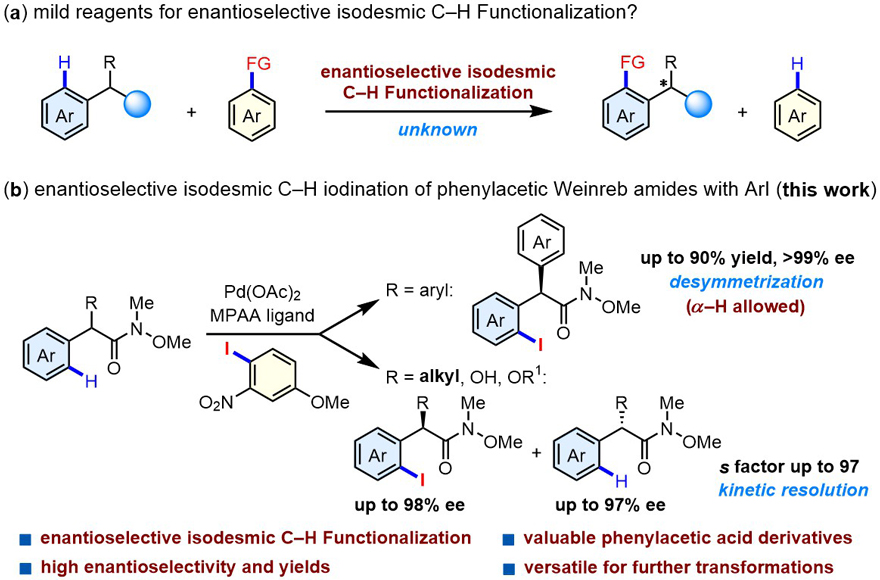
图1. 等键不对称C-H键活化
近日,中国科学院福建物质结构研究所和上海交通大学李纲研究员(点击查看介绍)团队首次报道了钯催化苯乙酸Weinreb酰胺的等键不对称C–H键碘化反应。在之前的研究中,该课题组在做C–H键芳基化的反应时候,意外发现2-硝基碘苯作为芳基化试剂的时候,有少量碘化物生成(Angew. Chem. Int. Ed. 2019, 58, 18502)。后续经过条件优化,作者成功开发了芳基碘作为温和的碘化试剂的一系列位点选择性以及非对映选择性的C–H键碘化反应 (CCS Chem. 2022, 4, 1889; Org. Lett. 2022, 24, 3657; Org. Lett. 2022, 24, 3926; Chin. J. Org. Chem. 2021, 41, 3511.),包括获得了一些与传统卤化不同选择性的反应 (Org. Lett. 2022, 24, 3926)。值得注意的是,该试剂特别适用于富电子底物的位点选择性C–H键碘化,比如苯酚类底物(Chin. J. Org. Chem. 2021, 41, 3511)。在此基础上,作者考虑把这一新型温和碘化试剂运用到不对称C–H键活化中,也许能够突破目前不对称C–H键卤化反应的一些局限。例如,目前一些亲电性的碘试剂能够导致背景碘化反应而影响不对称选择性。
作者最早使用苯乙酸底物作为研究对象,令人遗憾的是,通过大量的条件筛选,均不能有效的提高反应的对映体选择性。可能是苯乙酸底物容易消旋导致。随后,作者考虑引入弱配位的酰胺基团来考察其邻位不对称C–H键碘化的可行性。作者通过研究发现,使用Weinreb酰胺时,反应的产率以及对映体选择性较好。因此,作者选用Weinreb酰胺类型底物,继续进行配体的系统性筛选。首先,不同骨架的手性氨基酸配体是重点研究对象(图2,L1-L9),其中配体N-Ac-L-Ala-OH(L1)给出了最好的碘化反应结果。随后以L1为基础,作者设计合成了一系列N上带有不同保护基(例如L10-L13)的同系配体,并对它们的催化效果进行了考察。结果表明这些配体在该反应中的表现均不能超越L1。
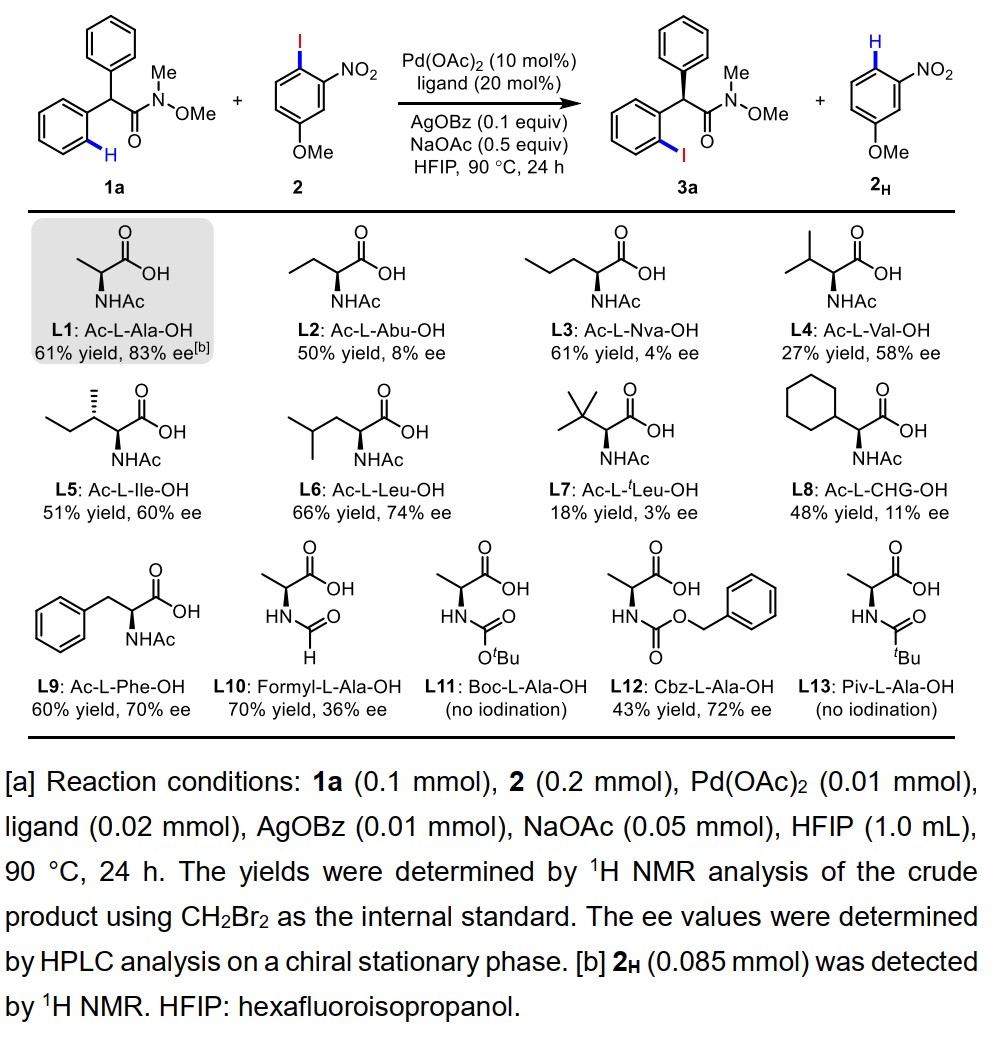
图2. 手性配体筛选
以L1作为手性配体,作者对其它反应条件进行了细致的筛选(图3)。实验结果表明,配体的量、银盐添加剂类型、反应温度、浓度等条件的改变均能对反应的收率和对映选择性产生影响。经过一系列系统的反应条件优化,通过利用20%的L1配体和AgOTf作为添加剂,作者以75%的收率以及98%的ee值得到了最优的反应结果(图3,entry 19)。当利用20%的L9配体时,可以得到70%的收率以及99%的ee值(图3,entry 21)。实验过程中,作者也考察了其他的碘化试剂(例如I2、IOAc、NIS等),但是相关反应的对映选择性非常低而且产率也比作者的硝基碘苯试剂差很多。

图3. 反应条件优化
在确定了最优的反应条件之后,作者对该反应的底物适用范围进行了考察(图4)。实验结果表明,无论是对于苯环邻位、间位以及对位取代基的底物(3a-3m),还是双取代的底物(3n-3r),都能在该体系中得到很好的产率和对映选择性的结果(最高大于99% ee)。
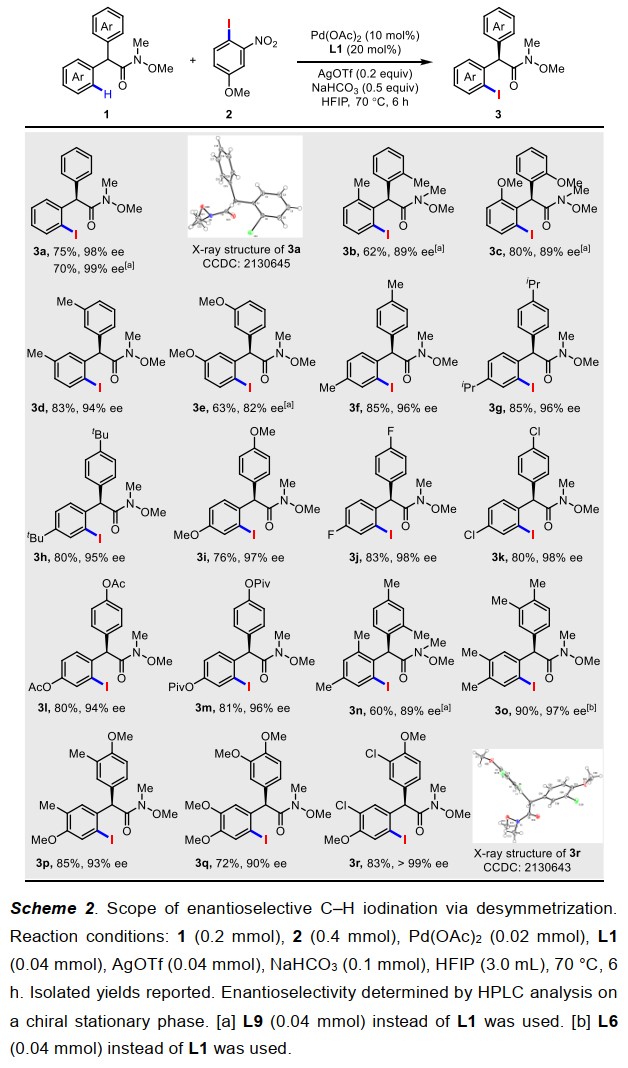
图4. 去对称化底物拓展
此外,该反应还可以通过更具挑战性的动力学拆分方式实现等键不对称C–H键碘化反应(图5)。很多α位不同取代基的苯乙酸衍生物以及苯环上具有不同取代基的底物都能在此体系中兼容。特别值得一提的是,一些常见药物分子比如:布洛芬、氟比洛芬、萘普生以及酮基布洛芬的Weinreb酰胺衍生物均能被有效的拆分(5a-5d)。同时,回收的原料在相反构型的配体作用下,可以得到相应的高ee值的等键不对称C–H键碘化产物(图6),进一步体现了该方法的潜在应用价值。
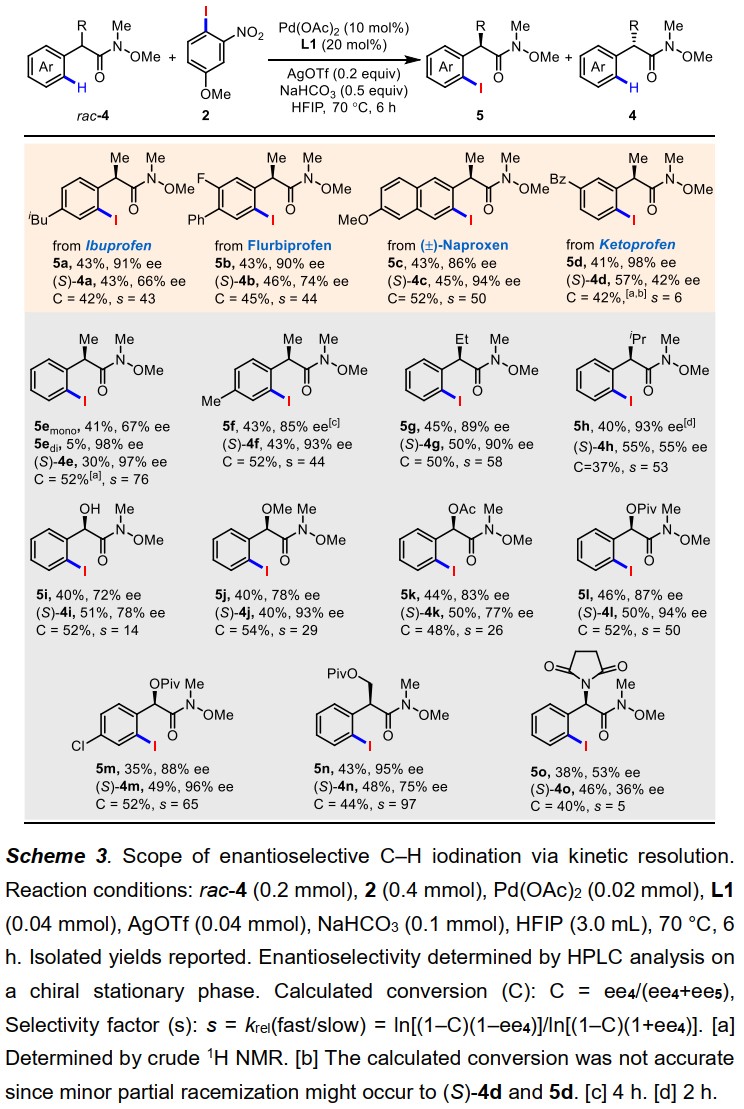
图5. 动力学拆分底物拓展
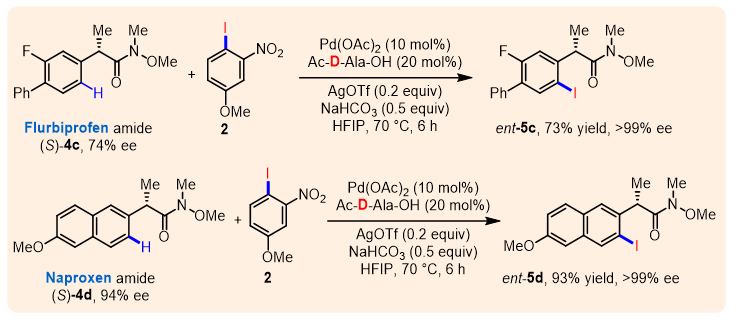
图6. 回收原料的等键C–H键碘化反应
在考察完底物的适用范围后,对于此方法放大到克级反应的适用性,作者也做了考察。结果表明,克级反应也能以较高的收率和对映体选择性得到目标产物。作者也粗略考察了产物的碳-碘官能团的偶联反应和Weinreb酰胺官能团的衍生化反应(图7)。考虑到苯乙酸分子骨架在药物分子中的重要性,这些反应体现了该方法学在药物化学研究中的重要应用潜力。
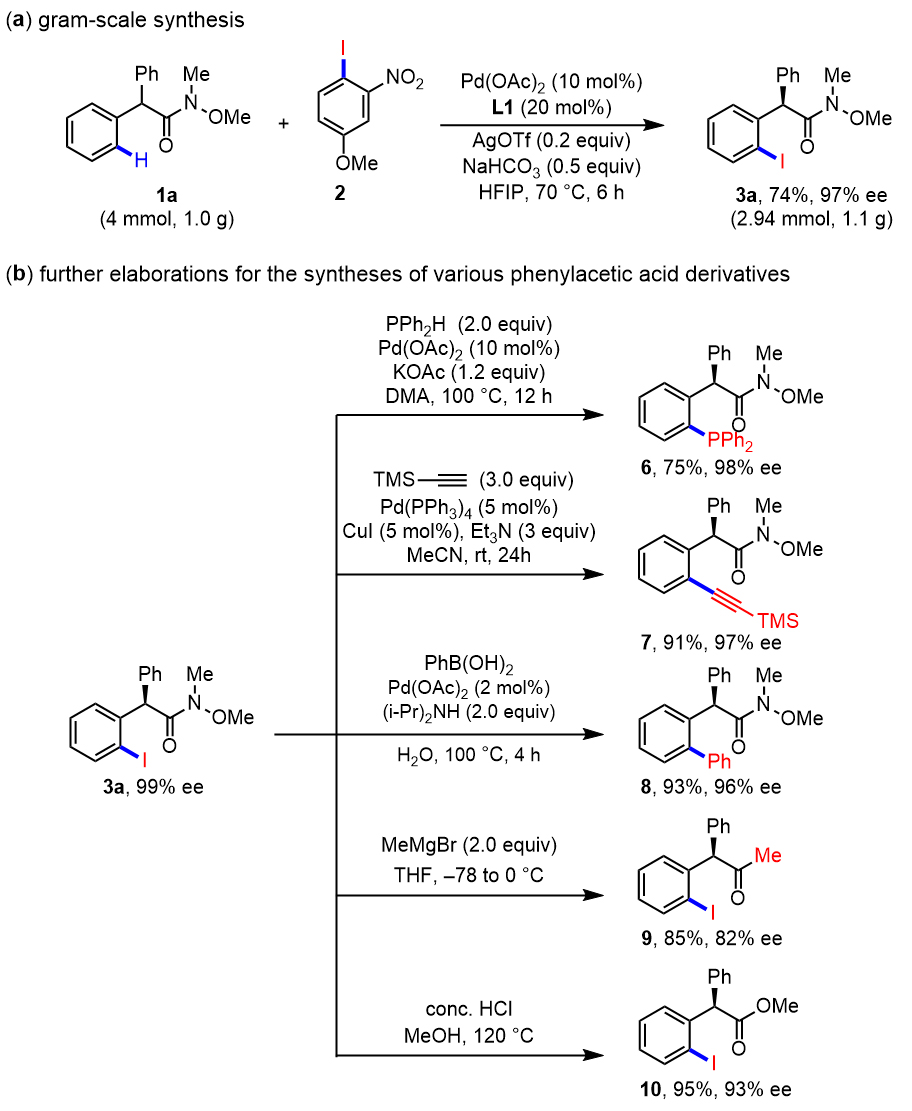
图7. 克级反应和应用转化
在前期研究基础和作者不对称实验结果的理解分析下,作者认为反应的机理如下:首先,醋酸钯与手性配体进行配体交换得到催化剂A,其与底物B配位发生C–H键活化,形成六元环钯中间体C,其与硝基碘苯进行氧化加成得到四价钯中间体D。在四价环钯中间体D中,硝基作为弱配位的官能团与Pd作用可能会抑制C–C键的还原消除,从而促进C–I键还原消除得到目标产物E以及芳基钯化合物F,化合物F再进行质子化得到硝基苯和钯催化剂A(图8)。
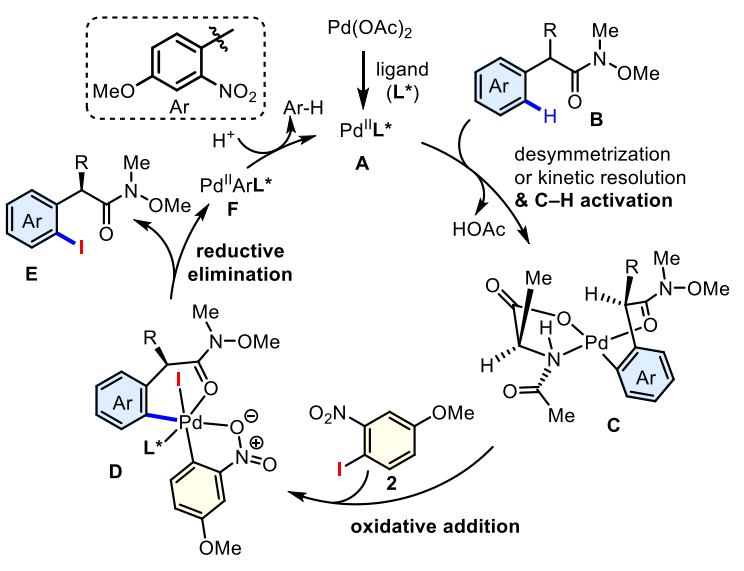
图8. 可能的反应机理
综上,通过使用温和的芳基碘的碘化试剂(即:4-甲氧基-2-硝基碘苯),作者开发了一种Weinreb导向的、手性氨基酸配体控制的苯乙酸衍生物的等键不对称C–H键碘化反应。该方法成功的以优秀的对映体选择性实现了含α-H苯乙酸底物的C–H键碘化去对称化和多种α位取代的苯乙酸底物动力学拆分反应,底物适用范围广。该工作是对映选择性的等键C–H键活化反应的首例报道,为多功能手性碘化物的构建发展了一个新的策略。此外,由于苯乙酸是很多常见药物的骨架结构、该反应为药物化学研究提供了一个可能的快速衍生化方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Palladium-Catalyzed Enantioselective Isodesmic C–H Iodination of Phenylacetic Weinreb Amides
Hang Wang, Chunlin Zhou, Zezhong Gao, Shangda Li, Gang Li
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202300905
导师介绍
李纲
https://www.x-mol.com/groups/Gang_Li
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号