清华大学尹航课题组2022年在天然免疫信号通路翻译后修饰领域所获研究进展概览
天然免疫是机体抵抗病原体入侵的“第一道防线”。在病原体入侵时,病原体相关分子模式(pathogen-associated molecular patterns, PAMP)会被机体的模式识别受体(pattern recognition receptor, PRR)识别并启动天然免疫应答。2013年,环状鸟苷酸-腺苷酸合酶(cGAS)由美国西南医学中心陈志坚教授发现,作为重要的双链DNA识别受体,cGAS是近年天然免疫领域的研究热点。cGAS介导的天然免疫信号通路在抗病毒感染、肿瘤免疫和自身炎症等疾病发生中发挥重要功能。因此,对cGAS功能调控的机制探索具有重要意义。
清华大学药学院尹航(点击查看介绍)课题组长期以来一直聚焦于天然免疫信号通路调控的探索。在2022年,课题组以蛋白质翻译后修饰为切入点,着重研究了cGAS的调控机制并取得了一系列的研究成果。4月,尹航课题组首次报道了cGAS能够发生棕榈酰化修饰并且负调控cGAS的激活,运用蛋白质质谱技术鉴定到cGAS第474位点的半胱氨酸为棕榈酰化修饰位点。结合shRNA介导的基因敲降和功能筛选发现,cGAS的棕榈酰化修饰主要由ZDHHC18催化。在分子机制上,棕榈酰化修饰后的cGAS与DNA的结合以及其自身的二聚化都受到抑制。在ZDHHC18敲低的人和动物巨噬细胞中,DNA引发的天然免疫信号显著增强,表明了棕榈酰化在体内对于cGAS激活的负调控作用。在动物水平,ZDHHC18基因敲除的小鼠品系表现出对DNA病毒感染更强的抵抗能力,揭示了cGAS棕榈酰化修饰重要的生物学意义。该研究成果发表在EMBO Journal 上。[1]
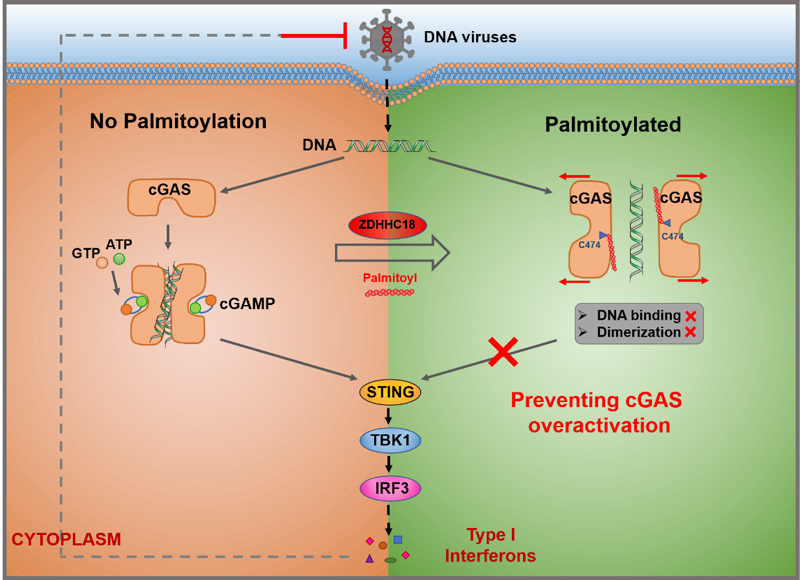
图1. ZDHHC18介导的棕榈酰化修饰负调控cGAS的激活。图片来源:EMBO J. [1]
5月,尹航课题组为了探究cGAS的泛素化修饰,筛选鉴定到泛素化连接酶MARCH8作为cGAS的相互作用蛋白。在细胞系中,过表达MARCH8削弱了dsDNA引起的天然免疫响应,而敲低或敲除MARCH8则产生相反的效果。在分子机制上,MARCH8催化cGAS的Lys411位点发生K63连接类型的多聚泛素化,进而抑制了cGAS与其配体DNA的结合,最终减弱了下游干扰素因子的产生。运用MARCH8基因敲除的小鼠模型,作者进一步证实了MARCH8对于cGAS介导的抗病毒天然免疫信号的负调控作用。该研究成果作为封面报道发表在Science Signaling 上。[2]

图2. MARCH8介导的泛素化抑制cGAS的激活。图片来源:Sci. Signal. [2]
10月,尹航课题组从去泛素化修饰的角度,首次通过免疫共沉淀和蛋白质质谱技术鉴定到去泛素化酶USP15作为cGAS的相互作用蛋白,并且USP15可以促进cGAS识别DNA和激活下游信号通路。细胞质中的双链DNA使得USP15的表达增加,并且USP15基因缺失的巨噬细胞丧失DNA引起的天然免疫信号通路的激活,说明USP15以正反馈的方式促进了DNA诱导的天然免疫信号通路激活。在分子机制上,USP15通过两种机制促进cGAS的激活。第一,USP15能够通过水解cGAS多种类型的泛素化修饰增强cGAS的活性;第二,USP15能够促进cGAS和DNA形成的相分离结构,促进cGAS与DNA的结合。上述两种机制互相平行,共同促进了cGAS的激活。USP15介导的cGAS去泛素化修饰和增强相分离的过程促进了DNA引起的天然免疫信号,揭示了天然免疫通路中的全新的微调控机制。该研究成果发表在Nucleic Acids Research 上。[3]
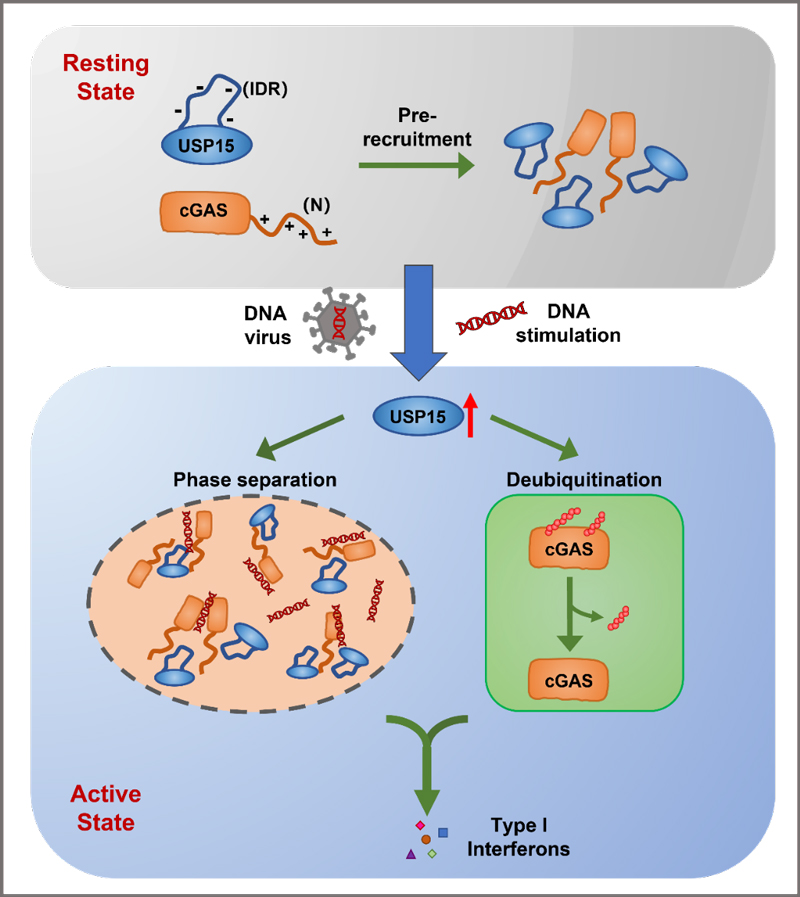
图3. USP15促进cGAS激活。图片来源:Nucleic Acids Res. [3]
除此之外,尹航课题组还关注与天然免疫息息相关的细胞焦亡信号通路的调控机制并取得了研究成果。2022年9月30日,尹航课题组应Chemical Communications 邀约,在Emerging Investigator十周年回顾特刊上发表了题为“Protein phosphatase 1 regulates phosphorylation of gasdermin D and pyroptosis (磷酸酶PP1调节gasdermin D蛋白的磷酸化和细胞焦亡) ”的研究论文。[4] 该工作发现了磷酸化修饰对GSDMD调控免疫细胞焦亡的突出贡献,磷酸酶PP1通过去磷酸化调节GSDMD-NT,影响GSDMD-NT寡聚,进而调控细胞焦亡。运用蛋白质谱,尹航课题组鉴定到GSDMD的多个磷酸化修饰位点。通过构建突变体进行表型验证,发现了包括T213在内的磷酸化修饰明显抑制细胞焦亡。利用已被解析的GSDMD-NT晶体结构,分析磷酸化修饰对其功能的调节,发现这些位点能影响与膜磷脂的结合及蛋白寡聚体的形成。利用体外实验证实T213位点磷酸化不影响其与膜磷脂的结合但能抑制蛋白寡聚,磷酸化修饰导致空间位阻的增加可能是抑制蛋白寡聚体形成的主要原因。机制研究发现磷酸酶PP1与GSDMD相互作用,通过敲降和过表达等细胞系的构建和表型验证,发现PP1在GSDMD被切割后对其去磷酸化,从而使GSDMD-NT寡聚诱导焦亡。
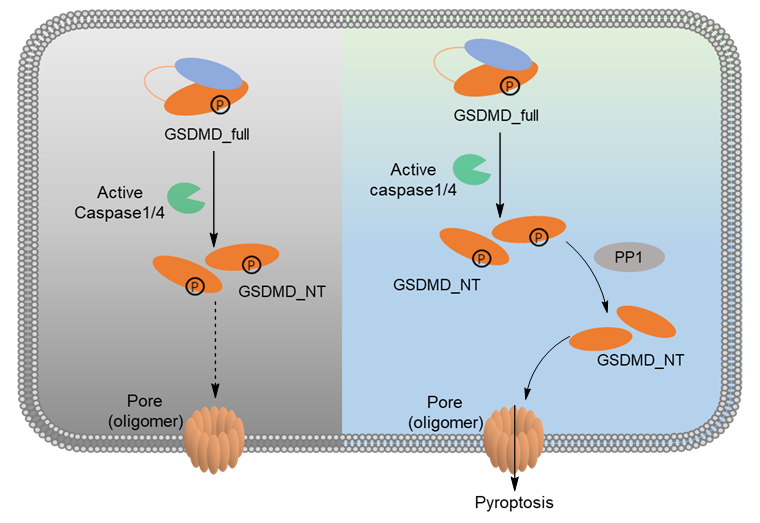
图4. 磷酸酶PP1调控GSDMD的功能。图片来源:Chem. Commun. [4]
参考文献:
[1] Shi et al., ZDHHC18 negatively regulates cGAS-mediated innate immunity through palmitoylation. The EMBO Journal. 2022 Jun 1;41(11), DOI: 10.15252/embj.2021109272
[2] Yang et al., MARCH8 attenuates cGAS-mediated innate immune responses through ubiquitylation. Science Signaling. 2022 May 3;15(732) DOI: 10.1126/scisignal.abk3067
[3] Shi et al., USP15 promotes cGAS activation through deubiquitylation and liquid condensation. Nucleic Acids Research, 2022 Oct 16, DOI: 10.1093/nar/gkac823
[4] Li et al., Protein phosphatase 1 regulates phosphorylation of gasdermin D and pyroptosis. Chemical Communications, 2022 Sep 30, DOI: 10.1039/d2cc03590a
尹航教授简介

尹航,清华大学药学院首任副院长,现任清华大学校学术委员会委员,药学院教授、中药研究院院长,兼任Bioorganic & Medicinal Chemistry Letters (Elsevier)主编、Journal of Extracellular Vesicle (Wiley)责任主编、中国细胞外囊泡研究与应用学会顾问,中国生物医药产业链创新与转化联盟常务理事及重大需求专委会主任委员,全国中药标准化技术委员会委员等。尹航教授团队在本领域一流期刊发表研究论文超过130篇(引用>16000次, H-Index>56);科研成果已申请专利11项,并有多项成果转化。尹航教授先后获得国家自然基金委杰出青年科学基金、北京市卓越青年科学家奖、以第一完成人获得中国药学会科学技术一等奖和教育部自然科学二等奖、美国化学学会大卫•罗伯特森杰出药物化学家奖、美国国家科学基金会杰出青年教授奖、美国癌症研究学会格特魯德•B•埃利恩奖、中美化学及化学生物学教授联合会OKeanos-CAPA资深科学家奖、悉德尼•金梅尔学者奖等多个奖项。

尹航教授实验室于清华大学生物医学馆合影
导师介绍
尹航
https://www.x-mol.com/university/faculty/46697
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号