温和条件下小分子介导的高效蛋白质偶联反应
发展蛋白质的定点修饰和偶联反应方法是阐述蛋白质功能的重要途径。蛋白质是一个相对比较不稳定的超分子组装体,蛋白质偶联和定点修饰反应条件对于保持蛋白质三维空间结构和生理功能至关重要。对于多结构域蛋白质而言,重构多结构域蛋白质不仅需要保持蛋白质完整的三维结构,而且还需要考虑维持各个结构域之间连接(linker)的原生动态柔性或协作性。借助多肽合成化学,自然化学连接(native chemical ligation)是构建蛋白质常用的有效手段,但是这类反应通常需要考虑蛋白质三维结构变性与复性的可逆性。为保持蛋白质稳定的三维结构,目前蛋白质偶联反应大多通过连接酶的参与。虽然已有众多活性比较高的连接酶报道,但是连接酶催化的蛋白质偶联反应通常存在可逆性,并且需要人为引入酶的特异识别位点序列。目前常见的蛋白质偶联反应在蛋白质三维空间结构稳定性、结构域动态完整性和连接效率等方面仍然存在较大的改进空间,尤其是适用于高分辨层次的蛋白质三维结构、动态特性与互作研究的偶联反应仍然具有较大的挑战。
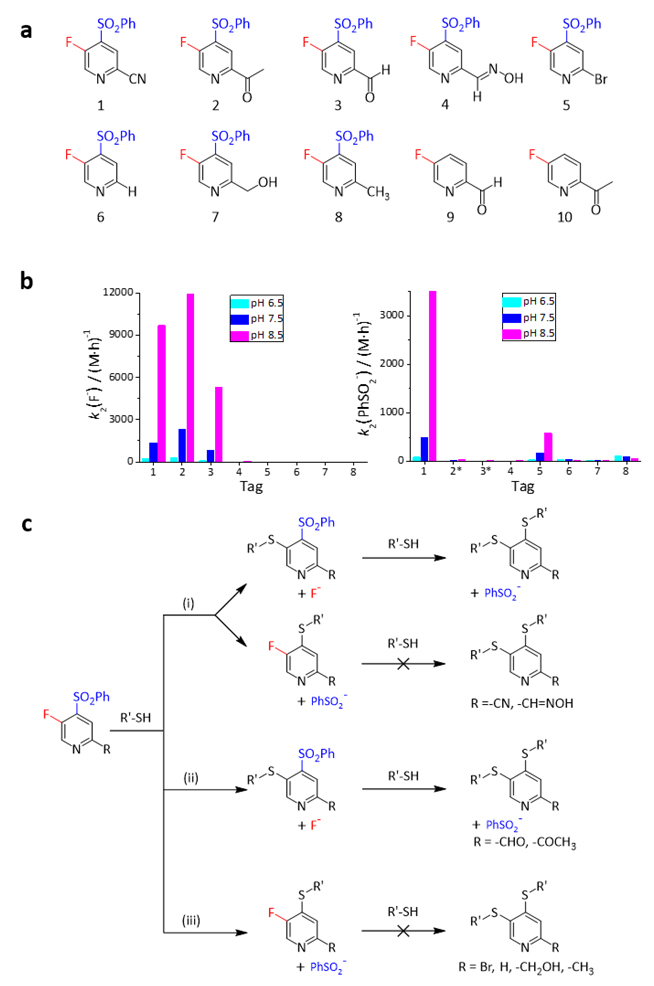
图1. 含有氟和苯砜基的吡啶衍生物的化学结构式以及这类小分子在水溶液中与自由巯基的反应速率和反应机制。图片来源:Angew. Chem.
南开大学苏循成教授(点击查看介绍)团队致力于发展蛋白质定点标记方法并应用于细胞内原子分辨率水平上的蛋白质动态结构与互作和重要生物小分子的活性定量分析。该团队前期研究发现吡啶上的苯砜基是生理条件下自由巯基的特异反应基团,并且通过高分辨核磁共振确认了该反应机理和产物(Chem. Commun., 2015, 2824),从而建立了基于吡啶苯砜基定点修饰蛋白质的反应策略并应用于不稳定酶催化中间体的三维结构测定(Angew. Chem. Int. Ed. 2016, 52, 13744)、细胞内蛋白质的三维结构测定(Chem. Commun. 2016, 10237)与细胞内联用NMR和EPR技术研究蛋白质三维结构变化和稳定性的方法(Angew. Chem. Int. Ed. 2017, 56, 2014; PNAS 2020, 117, 20566),并对苯砜基定点修饰蛋白质进行了较详细的论述(Acc. Chem. Res. 2019, 52, 1675)。为提高吡啶中苯砜基对于自由巯基的反应性,研究人员设计了一系列含有氟和苯砜基的吡啶衍生物(图1)并对这些小分子化合物与半胱氨酸等小分子巯基化合物的反应活性在不同pH情况下进行了定量测定。研究发现图1中化合物1-4中的氟和苯砜基均对自由巯基表现出活性,其中化合物1-3中的氟与苯砜基相比对小分子巯基表现出更高的反应活性(图1b)。化合物3(5-氟-4-苯砜基-皮考啉醛, FPPA)和4中的氟和苯砜基对巯基的反应可以视为两步反应。而化合物5-8中的氟没有表现出对巯基的反应活性,仅仅苯砜基表现出对自由巯基的反应活性,但是远低于1-3中的苯砜基活性。综合来看,在以上这些小分子化合物中,氟对巯基的反应性取决于其邻位苯砜基和对位取代基的拉电子能力,具体反应机制如图1c所示。由于FPPA中的氟和苯砜基均对自由巯基有较高的反应性,并且醛基可以与1,2-氨基硫醇发生环化反应,因此FPPA可以充当良好的蛋白质偶联试剂。基于此,FPPA可以首先通过氟与第一个蛋白质自由巯基的反应引入第一个蛋白质,随后可以通过苯砜基与第二个蛋白质的巯基进行亲核取代反应或者通过醛基与含有N端半胱氨酸的蛋白质发生环化反应,以此形成两个蛋白质或多个蛋白质的串联反应(图2)。

图2. FPPA介导的高效蛋白质偶联反应路线示意图。图片来源:Angew. Chem.
研究人员首先系统评价了FPPA对小分子如巯基乙醇和半胱胺酸的偶联反应并得到了较好的结果。随后利用ubiqutin、MBP、eGFP、XIAP、HSP90和Taq聚合酶等不同蛋白质系统评价了FPPA在多聚泛素(ubiquitin)、不同蛋白质间的交联(MBP和eGFP)、多结构域蛋白质(XIAP, HSP90和Taq)的重构等偶联反应中的效率和选择性(图3和图4)。结果表明,FPPA均表现出较高的连接效率。FPPA中的氟与第一个自由巯基的反应可以在生理条件下两个小时内定量完成,对于相同浓度的蛋白质反应物(~0.1 mM),第二步反应的苯砜基与第二个蛋白质的巯基在pH 8.5下可以在三个小时内完成,而提高第二个蛋白质的浓度可以显著提高连接效率。在pH 6.5下,第二步的醛基与N端半胱氨酸的环化速率更快,连接效率更高,并且在该条件下苯砜基对自由巯基没有明显的反应活性。

图3. FPPA介导的不同蛋白质间的偶联示意图。图片来源:Angew. Chem.

图4. FPPA介导的多结构域蛋白质的重构示意图。图片来源:Angew. Chem.
实验表明,FPPA只对蛋白质中溶剂暴露的自由巯基显示出较高的反应活性而对于较少溶剂暴露的巯基、自由氨基和羟基等没有明显的活性。eGFP有两个半胱氨酸(部分溶剂暴露),人源HSP90有六个半胱氨酸(部分溶剂暴露),XIAP中的BIR结构域有一个锌指结构域(三个半胱氨酸与一个锌离子配位),实验表明在偶联反应中FPPA对这些半胱氨酸均没有影响。FPPA介导的蛋白质偶联复合物在pH 4-10范围内或者血清中均具有较高的稳定性。
PCR实验表明通过FPPA偶联获得的Taq聚合酶与商业化Taq酶表现出相当的活性。通过高分辨核磁共振、选择性同位素片段标记等实验表明,FPPA介导的蛋白质偶联反应对于目标蛋白质三维结构没有影响并且比较完整地保留了结构域连接子(linker)的动态完整性和蛋白质功能,实现了多结构域蛋白质近乎“无痕”的连接。
由于FPPA介导的蛋白质偶联体中(图2)有醛基和苯砜基等可以进一步修饰的反应基团,因此可以实现三脚架式的偶联反应。结果表明,FPPA可以高效地实现多组分大分子的三脚架式偶联体。
总结
在该工作中,苏循成教授团队发展了一类高效的蛋白质偶联试剂FPPA,实现了近生理条件下不同蛋白质或同一蛋白质不同结构域间的高效连接。与已报道的多氟取代的芳香试剂相比,FPPA分子量小,没有明显的亲疏水性,并且其中的氟表现出定量化的巯基反应性。FPPA介导的蛋白质偶联体完全保留了目标蛋白质的三维空间结构和动态特性的完整性。这种偶联方法为构建线性、支链或三角架式的蛋白质偶联体提供了重要策略。FPPA偶联反应为重构多结构域蛋白质或难以纯化的蛋白质,特别是片段同位素标记蛋白质提供了近乎“无痕”的高效连接方法,为从原子分辨层次上研究蛋白质的三维结构、动态特性与互作提供了一种简便、高效的技术策略。该项工作得到了国家自然科学基金委的资助(21991081, 22174074 and 22161142018)
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Efficient Protein-Protein Couplings Mediated by Small Molecules under Mild Conditions
Xun-Cheng Su, Ling-Yang Zhang, Li-Na Zhao, Bin-Bin Pan, Ben-Guang Chen, Jia-Liang Chen, Cheng-Liang Zhai, Bin Li
Angew. Chem. Int. Ed., 2022, DOI: 10.1002/anie.202205597
导师介绍
苏循成
https://www.x-mol.com/university/faculty/11898
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号