两种β-羟基化氨基酸的不同生物合成机制
非核糖体肽 (NRPs) 是一类结构多样、生物活性广泛的天然产物,包含D型氨基酸、羟基化氨基酸和非蛋白质氨基酸等多种非天然氨基酸。羟基化氨基酸是由羟化酶催化形成的一类重要的手性模块化合物,β-羟基化天冬氨酸(β-OHAsp)广泛分布于天然产物中,尤其是铁载体类化合物,而β-羟基化组氨酸(β-OHHis)在天然产物中比较罕见。此外,Asp羟化酶和His羟化酶的催化机制至今未知,仅停留在生物信息学预测阶段。
近日,山东大学卞小莹教授(点击查看介绍)和山东大学/中科院深圳先进院张友明教授(点击查看介绍)团队,以基因组挖掘发现的新型非核糖体脂肽Glidomides为研究对象,通过生物信息学分析,体内原位敲除和大量的体外酶学相结合的策略,阐明了Asp羟化酶和His羟化酶的催化形成羟基化氨基酸的不同机制。首次确定了非核糖体肽合成酶中Interface结构域(I domain)的功能,通过保守位点E54和D166负责招募羟化酶GlmF,从而行使催化功能。
取得的研究结果如下:
(1)Glidomides(1-4)是由Schlegelella brevitalea DSM 7029产生的一类新型脂肽,包含一个罕见的羟基化组氨酸(threo-β-OH-L-His),羟基化天冬氨酸(threo-β-OH-D-Asp)及3-氨基吡咯烷-2-酮(S-Apo)。基因簇包含两个双加氧酶基因glmD和glmF,四个非核糖体合成酶(NRPS)核心基因及其他附属基因。
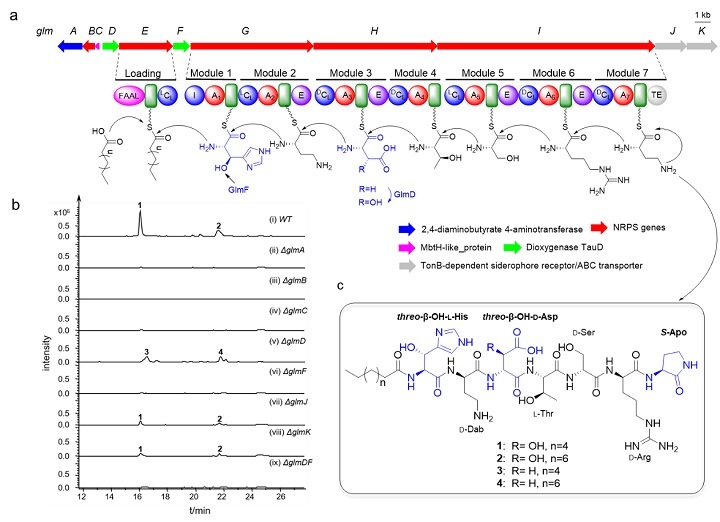
图1. Glidomides的生物合成基因簇示意图及结构。(a) glm生物合成基因簇示意图;(b) HPLC-MS分析不同突变株的甲醇粗提物;(c) Glidomides的化学结构。
(2)threo-β-OH-D-Asp的生物合成:缩合结构域(C domain)影响模块3中腺苷化结构域(A domain)对不同底物的识别能力;GlmD催化NRPS模块3中的CA3T3E蛋白结合的最佳底物L-Asp发生反应,产生β-OH-L-Asp,与终产物1中β-OH-D-Asp相比构型发生了异构。异构化结构域(E domain)处于该基因簇的中部,因此推测E结构域的真正催化底物是硫醇化结构域(T domain)绑定的肽酰,而不是T绑定的氨酰。T绑定的肽酰在体内发生异构化后,经多步模块反应形成终产物1。因此证明了GlmD催化Asp羟基化,且先于异构化。
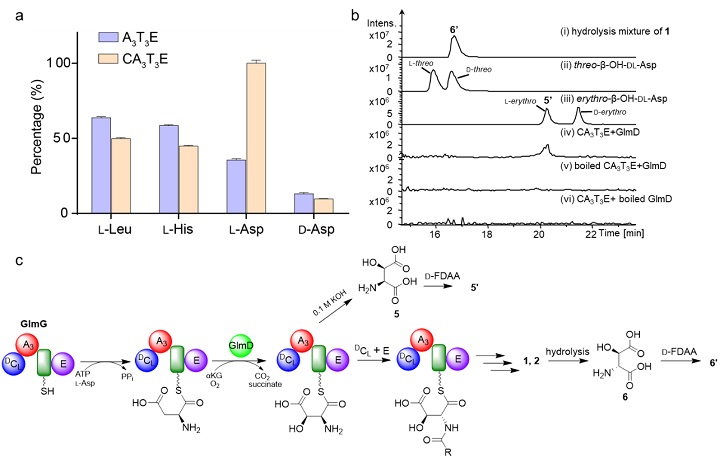
图2. A3结构域对底物的识别及LC-MS分析GlmD的体外酶学催化反应。(a) 通过焦磷酸盐释放方法检测A3结构域对底物的识别;(b) LC-MS分析GlmD的体外酶学催化反应;(c) GlmD催化天冬氨酸羟基化的示意图。
(3)threo-β-OH-L-His的生物合成:I结构域对A1结构域对底物专一性识别影响不大。GlmF催化NRPS模块1中IA1T1蛋白结合的底物L-His发生反应,产生β-OH-L-His,而A1T1蛋白则不产。为进一步验证该结果,负责脂肪酸链加载的GlmE蛋白分别与其进行反应,结果显示实验组均可以产生目标产物8和9,但A1T1蛋白组中的产量较IA1T1蛋白组的产量降低了90%。这一结果表明,I结构域在GlmF催化组氨酸羟基化的形成过程中起着重要作用。
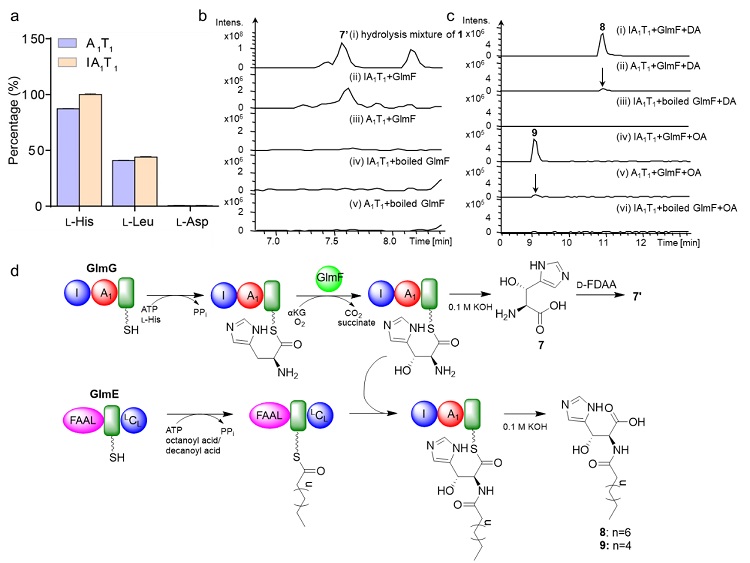
图3. A1结构域对底物的识别及LC-MS分析GlmF的体外酶学催化反应。(a) 通过焦磷酸盐释放方法检测A1结构域对底物的识别;(b) LC-MS分析GlmF的体外酶学催化反应;(c) LC-MS分析GlmF和GlmE的体外酶学催化反应;(d) GlmF催化组氨酸羟基化的示意图。
(4)IA1T1蛋白与羟化酶GlmF的互作研究:I结构域是缩合结构域的一个新分支,仅包含保守位点Asp,而缺少了保守的催化位点His。I结构域呈V字型,由N端亚结构域和C端亚结构域构成。作者发现R18,R19和R310三个位点阻断了底物结合口袋,保守位点R344的缺失使得T结构域无传递底物的结合位点。因此I结构域不能结合底物且不具有催化活性。突变结果显示,I结构域的突变体E54和D166与GlmF的互作条带消失,且E54和D166致使终产物1和2及体外目标产物8的产量降低。E54和D166在空间位置很近且氨基酸侧链均朝外,因此I结构域是通过保守位点E54和D166介导与GlmF的相互作用。与催化游离氨基酸底物的羟化酶相比,GlmF在结构上呈现一个特殊的entrance helix,推测其在羟基化氨基酸形成过程中与T结构域负责的底物呈递存在相关性。基于以上结果,首次提出组氨酸羟基化产生机制:A1结构域识别L-His,递送形成T1-L-His;I结构域通过E54和D166招募羟化酶GlmF;T1结构域将底物递送至GlmF的底物结合口袋,发生羟基化后,T1结构域进一步将羟基化底物递送至GlmE的C结构域催化口袋,与脂肪酸链发生缩合。
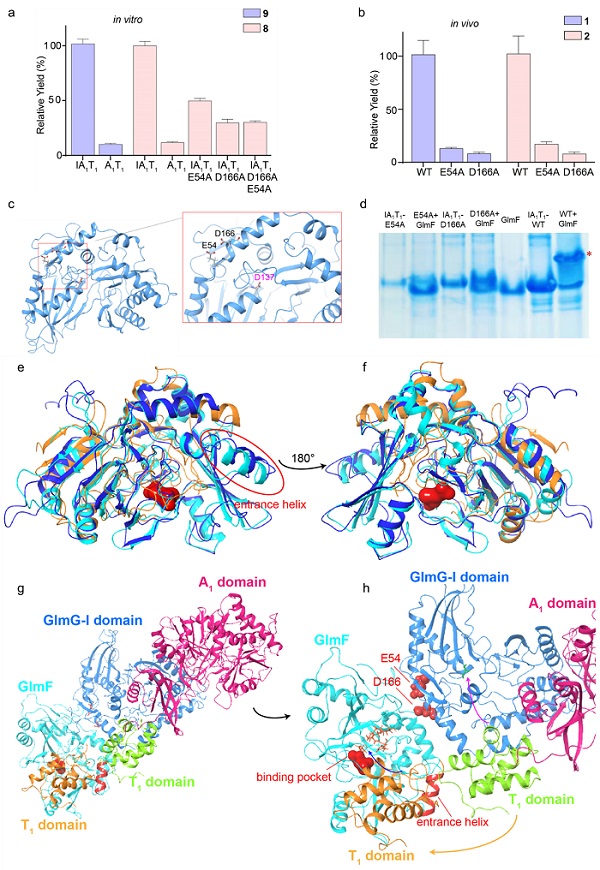
图4. IA1T1与羟化酶GlmF的互作研究及组氨酸羟基化形成机制。(a) IA1T1突变体的体外活性检测;(b) IA1T1突变体的体内活性检测;(c) I结构域蛋白的结构;(d) IA1T1突变体与GlmF的相互作用分析;(e)和(f)羟化酶GlmF和GlmD与游离氨基酸底物的羟化酶的结构比对;(g)和(h)组氨酸羟基化发生机制。
(5)S-Apo的生物合成:硫酯酶结构域(TE domain)通过水解或环化方式从装配线上释放天然产物。体内和体外结果表明,S-Apo可由T结构域绑定的氨基酸底物Dab自发的亲核攻击而形成,无需酶催化。但与此同时,根据体内外相应产物产量的比较,作者推测在Glidomide合成装配过程中TE可能保护或维持T结构域绑定的氨基酸底物Dab不发生环化,待T绑定正确的肽酰产物时,TE可能促进Dab的自由氨基攻击羰基而形成Apo,并释放终产物。
本研究不仅为β-羟基化非天然氨基酸的生物合成提供了研究思路,而且在重新设计并改造NRPS获得更多新型天然产物方面具有指导意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Biosynthesis of Glidomides and Elucidation of Different Mechanisms for Formation of β-OH Amino Acid Building Blocks
Hanna Chen, Lin Zhong, Haibo Zhou, Tao Sun, Guannan Zhong, Qiang Tu, Yan Zhuang, Xianping Bai, Xingyan Wang, Jiaying Xu, Liqiu Xia, Yuemao Shen, Youming Zhang, Xiaoying Bian
Angew. Chem. Int. Ed., 2022, 61, e202203591, DOI: 10.1002/anie.202203591
导师介绍
卞小莹
https://www.x-mol.com/university/faculty/60224
张友明
https://www.x-mol.com/university/faculty/60223
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号