Chem. Sci.:快速选择性标记内源蛋白新方法
蛋白质的化学修饰对于在复杂的生物系统中表征蛋白质功能和药物开发具有非常重要的意义。由于针对蛋白质的化学反应需要在温和的水溶液中进行,而且蛋白质和生物系统中存在多样的化学官能团,从而使得天然或内源蛋白质的选择性化学修饰具有挑战性。
近日,瑞典于默奥大学(Umeå University)的吴耀文教授(点击查看介绍)课题组在Chemical Science杂志上发表论文,他们开发了基于苯并三唑(BTA)的新型亲和标记探针。BTA探针选择性地共价修饰靶标蛋白的配体结合位点附近的赖氨酸残基,半数反应时间(t1/2)最快仅需28秒。反应速率常数可与最快的生物兼容的反应相媲美(图1和2a)。该方法适用于在体外和活细胞中选择性标记细胞质和细胞膜上的蛋白质。BTA化学可广泛用于标记天然/内源性蛋白质、药物靶点鉴定和共价抑制剂的开发。
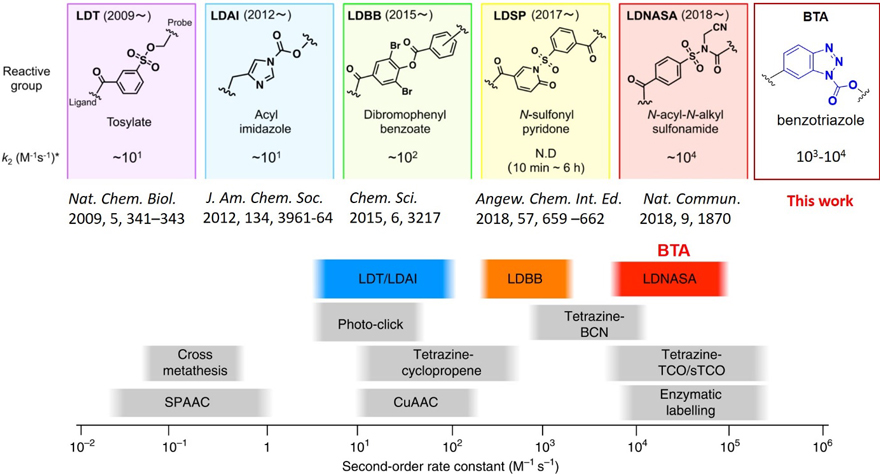
图1. 亲和标记官能团和它们的速率常数。
蛋白质亲和标记原理:基于邻近驱动的蛋白质亲和标记化学一直是一种强有力的选择性标记天然或内源性蛋白质方法并用于共价抑制剂的开发。蛋白质-配体相互作用促近了亲电基团附近的氨基酸残基对其进行亲核进攻,从而导致共价结合(图2b)。根据不同应用目的,亲和标记法可以实现配体的共价结合,最终不可逆地抑制蛋白质功能或将蛋白质锁定在一个特定的状态。或者,在标记内源性蛋白质后伴随着配体的释放,从而在不破坏蛋白的功能的前提下对体内的蛋白质进行失踪或者捕获。亲和标记方法操作相对简单,无需进行额外的基因操控即可轻松实现。
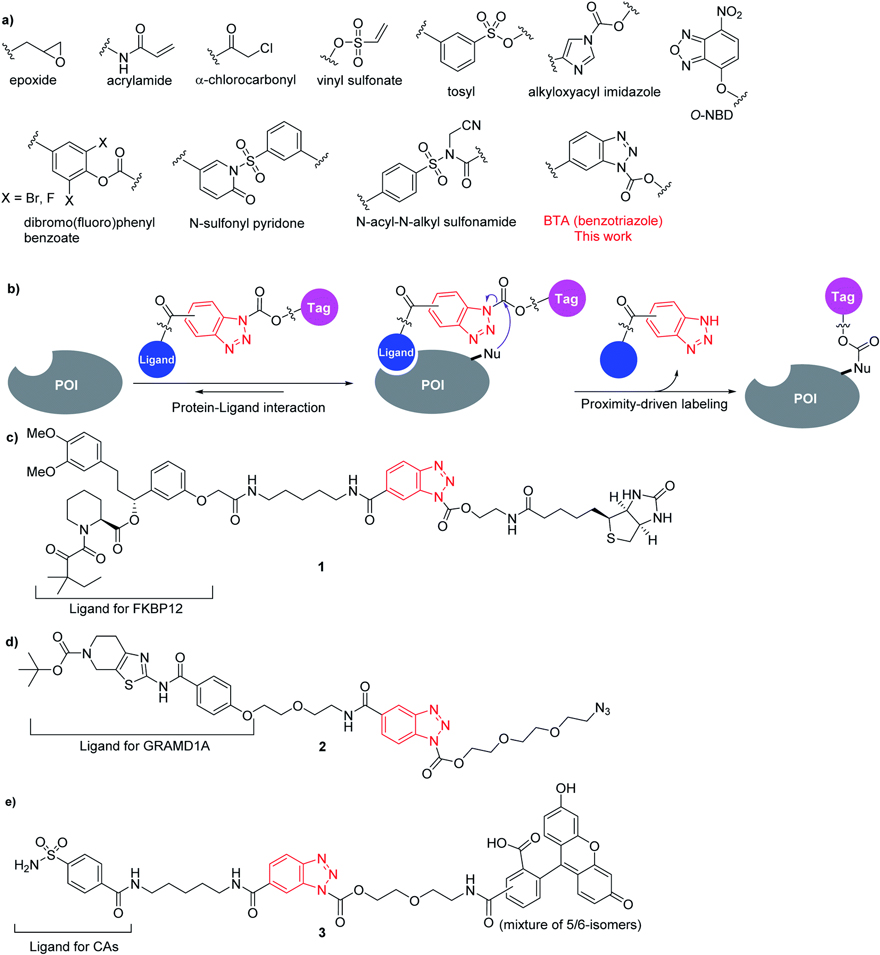
图2. (a) 用于亲和标记的反应基团。(b)BTA化学选择性亲和标记蛋白质的示意图。(c-e)本研究中用于标记 FKBP12(c)、GRAMD1A(d)和carbonic anhydrases(CAs)(e)的化合物。
作者合成了三个探针分别用来标记FKBP12、GRAMD1A和carbonic anhydrases (CAs)蛋白(图2c-e)。这三个探针含有不同种类的标签(Tag):生物素、叠氮化合物和荧光素。
为了验证设计的可行性,作者设计了探针1,其含有FKBP12蛋白的配体(SLF)、苯并三唑和生物素标签(图2c)。作者通过SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)和蛋白质印迹(Western Blot)对化合物1 与重组FKBP12蛋白的共价结合进行评估。5 µM的 FKBP12 与 10 µM的探针1在水溶液中快速反应,半数反应时间为 113 秒(图3a,b)。作者同时与目前报道最快的LDNASA探针(Nat. Commun. 2018, 9, 1870)的反应速度进行比较。在相同条件下,LDNASA 观察到的标记反应的半反应时间为151秒。因此,在同样条件下标记FKBP12蛋白,BTA化学的速度是LDNASA化学约1.3倍。通过LC-MS/MS分析显示,探针1标记了FKBP12蛋白的配体结合位点附近的第52位赖氨酸残基(Lys52,主要标记位点)和第35位赖氨酸残基(Lys35,次要标记位点)(图3c)。

图3. FKBP12 蛋白的体外标记。(a) 5 µM的FKBP12与10 µM 的1 的标记反应的SDS-PAGE和蛋白质印迹分析。(b) 使用 10 µM 探针1(红色)和探针LDNASA(蓝色)与 5 µM FKBP12蛋白的标记反应动力学。实线为单指数方程拟合曲线用于确定 t1/2。(c) FKBP12-SLF复合体的晶体结构(PDB ID:1FKG)。探针1的标记位点标记为红色(Lys52,主要标记位点)和蓝色(Lys35,次要标记位点)。SLF以绿色显示。
为了检验在生物环境中使用BTA化学的可行性,作者在细胞裂解物中使用探针1来标记FKBP12 蛋白。HeLa细胞裂解物(总蛋白浓度为 1.5 mg/mL)与重组 FKBP12 (2 µM) 和探针 1 (2.5-10 µM) 在37 °C下反应仅5分钟,可以明显观测到标记反应。标记反应可以完全被竞争性抑制剂SLF所抑制(图 4a)。非特异性标记甚至在探针1的浓度高达10 µM和反应时间延长至2小时的条件下未被观察到。
接下来作者在活细胞中标记内源的FKBP12蛋白。用1 µM 的探针1 标记HeLa活细胞,然后将细胞裂解,解液物用链霉亲和素珠进行免疫沉淀。作者观察到内源的 FKBP12 被特异地捕获(pull-down)。这些结果表明BTA化学是生物兼容性的,可用于在生物环境中选择性地标记内源蛋白质。
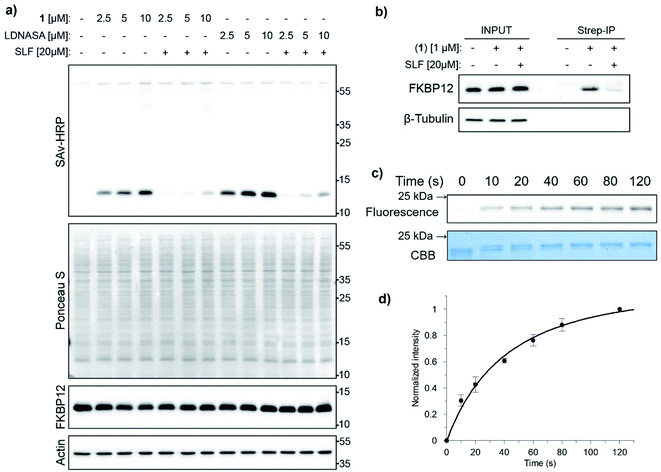
图4. (a) 用1或 LDNASA (2.5-10 µM) 在HeLa 细胞裂解物中标记2 µM的重组FKBP12蛋白的SDS-PAGE 和蛋白质印迹分析。标记时间5分钟。(b) 用1标记HeLa细胞并使用链霉亲和素珠进行免疫沉淀。(c) SDS-PAGE 和凝胶内荧光分析用 10 µM探针2标记 5 µM GRAMD1A (Start domain)。(d) 根据图c数据所拟合的标记反应动力学曲线。
自噬是一种进化上保守的细胞内降解系统,自噬参与许多生理与致病机制。最近,该课题组近报道了新的自噬抑制剂autogramins 并确定了他们的细胞靶标蛋白GRAMD1A。Autogramins与胆固醇竞争与GRAMD1A 的StART结构域结合,从而抑制其自噬体生物发生所需的胆固醇转移活性(Nat. Chem. Biol., 2019, 15, 710–720)。为了进一步拓展BTA化学的应用范围,作者基于autogramin-2合成了标记GRAMD1A蛋白的探针2,并显示探针2能够特异地修饰GRAMD1A蛋白配体结合位点附近的第158位赖氨酸残基(Lys158)。10 µM的探针2和5 µM 的GRAMD1A (StART domain) 的半数反应时间仅为 28 s ,二级反应速率常数为 (2.7 ± 0.4) × 103 M-1 s-1 (图4c,d)。
碳酸酐酶(CA)是催化二氧化碳和碳酸之间相互转化的酶家族,细胞表面跨膜CA(CA9和CA12)在许多肿瘤中过度表达,它们有助于肿瘤微环境的酸化和肿瘤的恶性化,从而成为一种有价值的癌症诊断和预后生物标志物。CA12在乳腺癌细胞中过量表达,为了在乳腺癌细胞中标记内源的碳酸酐酶,作者合成了含碳酸酐酶抑制剂芳基磺酰胺、BTA和荧光素的探针3。共聚焦显微镜显示探针3可以快速标记乳腺癌细胞系MCF-7的细胞膜(图5a,b),标记可以被 CA竞争性抑制剂依索唑胺 (ethoxzolamide,EZA) 所消除。为了验证标记反应的特异性,作者把标记后的MCF-7细胞裂解并通过变性SDS聚丙烯酰胺凝胶电泳、蛋白质印迹和免疫沉淀实验证实被选择性标记的是CA12蛋白(图5c,d)。

图5. 使用探针3标记内源性CA12蛋白。(a)用探针3标记的MCF7细胞的代表性共聚焦荧光图像。(b)荧光素荧光强度的量化表,数据来源于图5a。(c) 在竞争性抑制剂EZA存在和不存在的情况下用3孵育的MCF7 细胞的蛋白质印迹分析的。(d)用3标记MCF7细胞然后使用抗FITC抗体进行免疫沉淀。CA12 和荧光素标记的蛋白分别使用抗-CA12和抗-FITC的抗体对蛋白质进行可视化。
总结
作者开发了BTA亲和标记化学,表明它们可以快速地和高选择性地修饰天然或内源蛋白质。BTA的反应速率比LDNASA化学更快,并且与最快的生物正交反应相当。模块化设计使得BTA探针可对各种细胞质和细胞膜蛋白修饰不同的标签。作者认为 BTA化学可以为标记天然或内源蛋白质、靶点鉴定和开发共价抑制剂提供强有力的工具。
本文的通讯作者是瑞典于默奥大学的吴耀文教授。信晓义博士(现就职于柏林工业大学)、张余博士和Dale Corkery博士为本文的共同第一作者。徐州医科大学的周愿教授、瑞典卡罗琳斯卡医学院的Massimiliano Gaetani博士、Susanna Lundström和Roman Zubarev教授提供了LC-MS/MS的数据分析。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Ultrafast and selective labeling of endogenous proteins using affinity-based benzotriazole chemistry
Xiaoyi Xin, Yu Zhang, Massimiliano Gaetani, Susanna L. Lundström, Roman A. Zubarev, Yuan Zhou, Dale P. Corkery, Yao-Wen Wu
Chem. Sci., 2022, DOI: 10.1039/d1sc05974b
导师介绍
吴耀文
https://www.x-mol.com/university/faculty/50160
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号