JACS:α-三烷基-α-叔胺的模块化合成
众所周知,α-三烷基-α-叔胺广泛存在于药物分子、农用化学品、天然产物以及小分子生物探针中(图1B)。如图1A所示,α-叔胺(ATA)单元中氮原子上连接的α-碳含有3个C-C键,这些取代基会影响胺的碱性和亲脂性,从而可以调节与生物受体的相互作用。此外,当氮原子上带有两个取代基时,α-叔胺的存在会显著影响分子的拓扑结构。尽管如此,但要想有效地合成α-三烷基-α-叔胺单元仍颇具挑战,这是因为合成过程中通常会受到其它组分空间位阻的影响。事实上,不少课题组发展了许多创新策略来合成ATA结构,即通过形成C-N键来构建α-三级中心,例如:Ritter型反应的亲核胺化和金属催化的加氢胺化、分子重排(如:Curtius反应)等。
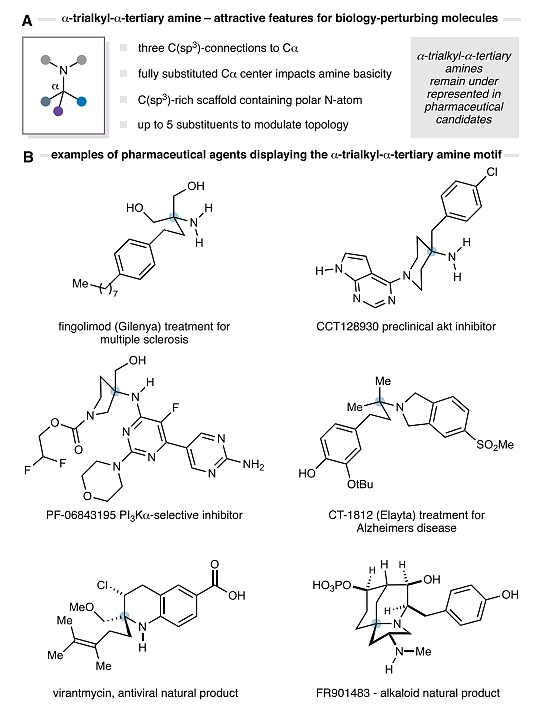
图1. 含有α-三烷基-ATA结构的药物分子。图片来源:J. Am. Chem. Soc.
近年来,化学家们利用可见光介导的光氧化还原催化实现了α-三烷基-α-叔胺的合成(图2A),即通过伯胺的直接α-氢原子转移(HAT)和酮亚胺的单电子还原(SET)产生α-氨基自由基,后者可进一步转化为α-三烷基-α-叔胺。不过,这些反应的底物局限性较大。在此基础上,英国剑桥大学的Matthew J. Gaunt教授课题组从二烷基酮、苄胺和烯烃三种组分出发,利用可见光介导的光催化实现了一系列α-三烷基-α-叔胺的模块化合成(图2B)。具体而言,酮和伯胺原位生成二烷基亚胺,后者经可见光介导的单电子还原生成α-氨基自由基中间体,该自由基可与一系列烯烃发生Giese型加成反应,从而形成所需的α-三烷基-α-叔胺中心。相关成果于近期发表在J. Am. Chem. Soc. 上。

图2. α-三烷基-ATAs的合成方法。图片来源:J. Am. Chem. Soc.
首先,作者选择苄胺1a、酮2a为模板底物,在4 Å分子筛的作用下原位形成亚胺6a,后者和丙烯酸叔丁酯3a在Ir(dMeppy)3(1 mol%)和少量酸添加剂的存在下用蓝色LED灯进行辐照,均能得到所需的目标产物4a,尽管收率较低(图3A,entry 1-3)。有趣的是,当反应中没有酸添加剂时,反应收率较高(80%)。为此,作者对反应条件进行了优化,结果显示二苯甲胺1b的反应效果更好,能以85%的收率获得更稳定的二苯甲酮亚胺产物4b,并且产物在色谱纯化后易分离。另外,对照实验表明没有光催化剂反应无法进行。值得一提的是,作者发现亚胺的预缩合并不是必需的,胺1b、酮2a、丙烯酸叔丁酯3a、光催化剂和分子筛可以一锅法进行多组分反应,以71%的收率得到所需产物4b(图3B)。
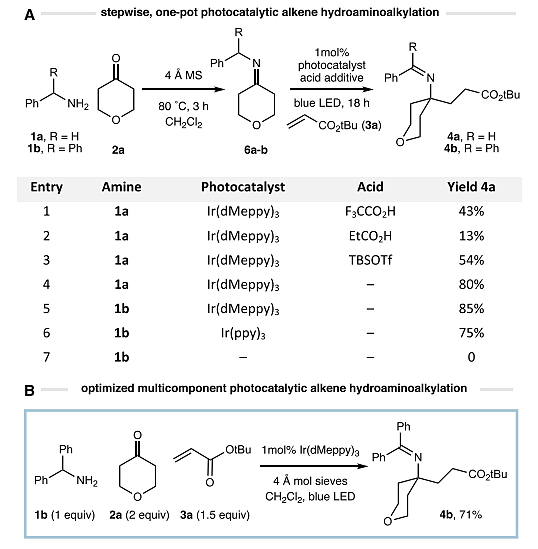
图3. 反应条件优化。图片来源:J. Am. Chem. Soc.
在最优条件下,作者探究了该反应的底物适用性。首先,他们考察了酮的底物范围,结果显示五至七元环酮(4b-4e)甚至含有O-、S-、N-杂原子的六元环酮(4f-4j)都能顺利地实现这一转化(图4A),尽管环戊酮和环庚酮的收率较低(4d-4e)。相比之下,3-吡咯烷酮的反应效果更好,以58%的收率得到所需产物4k。此外,非环状酮也能兼容该反应,尽管是与体积较小的苄胺1a进行预缩合(图4B)。需要指出的是,将醛亚胺单元进一步转化为伯胺后可以更直接地分离这些产物(5m-5x),并以较高的收率制备了一系列α-三烷基ATA产物。其次,作者研究了烯烃的底物范围,结果显示苯基乙烯基砜(7a)、甲基乙烯基酮(7b)、乙烯基硼酸酯(7d)、双取代的环戊烯酮(7e)和甲基丙烯酸苄酯(7f)甚至缺电子的炔烃(7c)都能以中等至优异的收率获得所需产物(图5A)。另外,作者还考察了苯乙烯的底物范围,发现不同基团取代的苯乙烯(7g-7m)以及2-、3-、4-乙烯基吡啶(7n-7r)都能兼容该反应(图5B),以中等至较好的收率得到目标产物,尽管富电子基团取代的苯乙烯收率较低。最后,作者考察了苄胺的底物范围(图5C),并用硼氢化钠将所得的醛亚胺产物还原为相应的仲胺(8a-8f)。
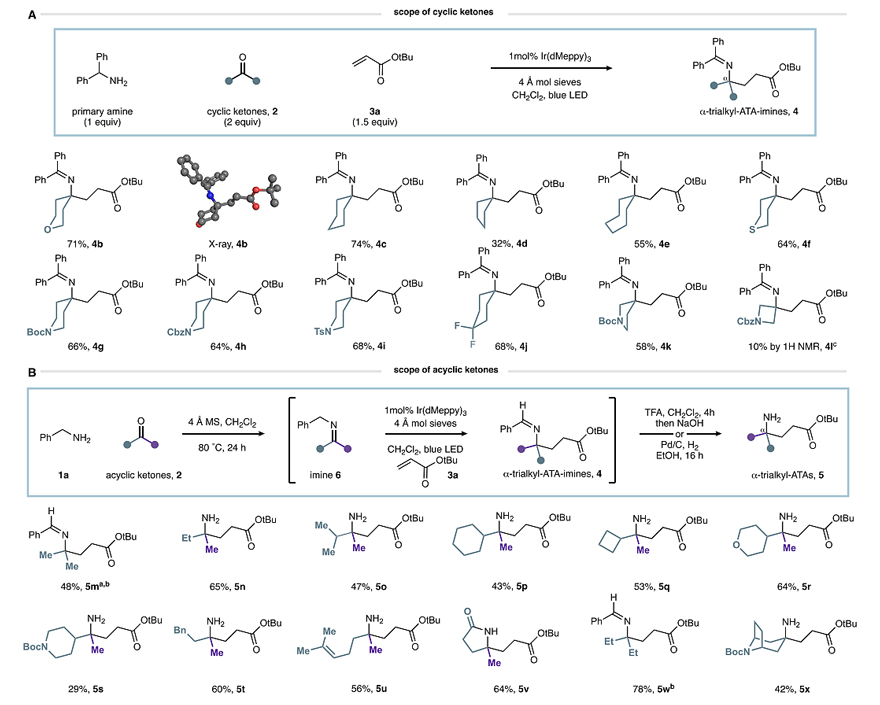
图4. 底物拓展一。图片来源:J. Am. Chem. Soc.
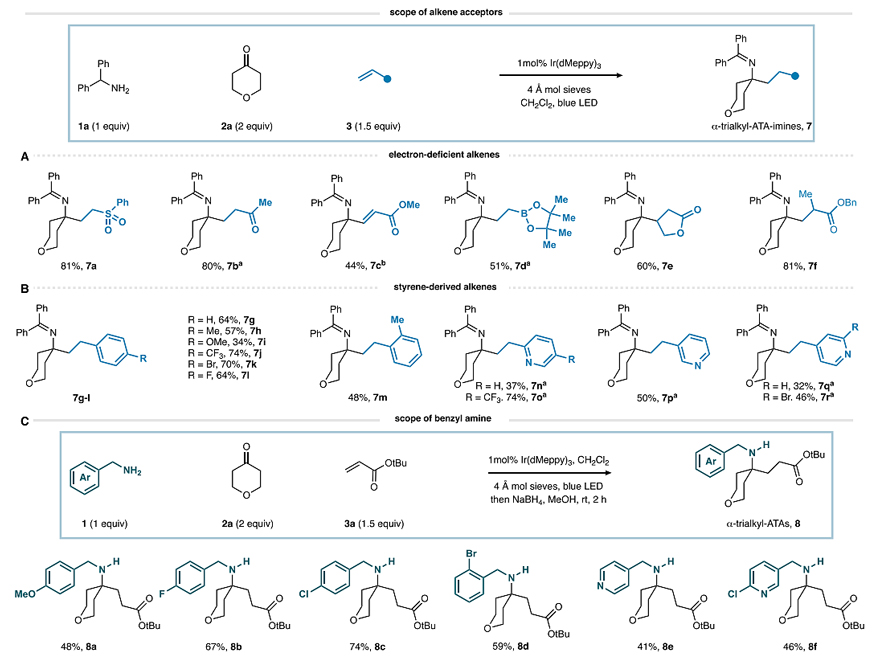
图5. 底物拓展二。图片来源:J. Am. Chem. Soc.
为了证明该反应的合成价值,作者从二苯甲胺1b、酮2x和4-辛基苯乙烯3r出发,在标准光催化条件下反应48 h,然后用酸性水溶液进行处理,以17%的收率得到Fingolimod(9,图6A),后者是一种受体调节剂,可用于治疗复发缓解型多发性硬化症。另外,作者还将一系列杂环酮与二苯甲胺1b、2-溴苯乙烯(3s)或2-氟-3-乙烯基吡啶(3t)进行反应,以良好的收率获得所需的α-三烷基-ATAs(10a-10e,图6B),其中10a和10b经钯介导的分子内Buchwald-Hartwig偶联反应得到相应的1,2,3,4-四氢喹啉(11a和11b)。类似地,10c-10e在Hünig碱和DMF的存在下于120 ℃下进行反应,以较好的收率得到相应的1,2,3,4-四氢萘啶(11c-11e)。
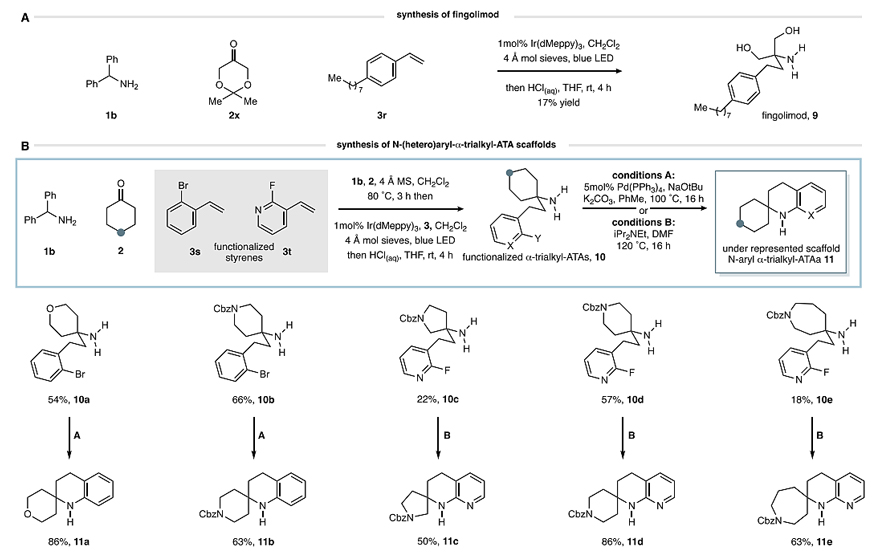
图6. 产物衍生化。图片来源:J. Am. Chem. Soc.
接下来,作者进行了一系列机理研究。如图7A所示,当酮2a、烯烃3a和α-氘代二苯甲胺(d1-1b)在标准条件下进行反应时,以接近定量的氘掺入率在酯基的邻位C-H键进行氘代并获得相应的亚胺产物d1-4b,进一步证实了1,5-HAT过程。另外,作者将3-丁烯胺12和酮2a进行缩合得到相应的亚胺13,后者在标准条件下进行反应,以中等的收率得到杂螺环14(图7B),这可能是由于α-氨基自由基中间体与侧链烯烃发生分子内5-exo-trig闭环以及随后的HAT过程导致的。接着,作者在Ir(dMeppy)3的存在下,对二苯甲胺1b、酮2a、烯烃3a、亚胺 6b 和产物4b的溶液分别进行了Stern-Volmer 猝灭实验,结果表明亚胺6b是Ir(dMeppy)3激发态的有效猝灭剂(图7D)。需要指出的是,反应中存在的4 Å分子筛既可以作为Lewis酸,也可以与水相互作用产生质子源。然而,当分离出的亚胺在没有4 Å分子筛的条件下进行反应时,仍能以80%的收率得到产物4b(图7E,entry 2),这意味着其它过程也会产生质子,即亚胺6b的互变异构体烯胺15经单电子氧化形成自由基阳离子int-VIb,后者的酸性N-H键能够实现亚胺6b的质子化,从而形成酮亚胺阳离子中间体int-Ib。

图7. 机理研究。图片来源:J. Am. Chem. Soc.
在此基础上,作者提出了可能的反应机理(图8)。首先,二苯甲胺1b和酮2a原位形成亚胺6b,后者经质子化生成酮亚胺阳离子中间体int-Ib。接着,Int-Ib被[Ir(II)(dMeppy)3]-还原为α-氨基自由基int-IIb,后者与烯烃3a发生Giese加成得到中间体int-IIIb,然后经1,5-HAT过程生成二苯基取代的α-氨基自由基int-IVb。随后,int-IVb被[Ir(III)(dMeppy)3]*氧化为酮亚胺阳离子int-Vb,同时再生还原性物种[Ir(II)(dMeppy)3]-来关闭光催化循环。最后,酮亚胺阳离子int-Vb与起始亚胺6b进行质子转移便可得到最终产物4b。

图8. 可能的反应机理。图片来源:J. Am. Chem. Soc.
总结
Matthew J. Gaunt教授课题组从简单易得的前体二烷基酮、苄胺和烯烃出发,利用可见光介导的多组分反应,成功地制备了一系列α-三烷基-α-叔胺化合物。该反应不仅条件温和、官能团耐受性好,而且底物范围广,可以直接合成一系列N-芳基螺杂环α-三烷基-α-叔胺骨架。可以预见,该方法将在药物研发和工业生产中具有重要的应用价值。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Modular Photocatalytic Synthesis of α-Trialkyl-α-Tertiary Amines
J. Henry Blackwell, Georgia R. Harris, Milo A. Smith, Matthew J. Gaunt
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c07402
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号