秦天课题组Nat. Chem.:遇水架桥—分子内偶联合成多取代双环烷基硼酸酯
众所周知,笼状双环分子凭借其特殊的几何形状、物理性质以及理论意义等特性,长期以来一直是科学家们的研究热点。近年来,药物化学家发现笼状双环分子具有调节候选药物药代动力学和理化性质的能力(图1a),并在药物研发中取得了显著的成效。其中双环[1.1.1]戊烷(BCPs)被广泛认为是苯环的生物电子等排体,而当BCPs上的桥头位置(C1与C3)被取代时,即可获得一系列笼状双环骨架(图1b)。目前,构建BCPs的方法主要有以下几种:1)Wiberg、Michl、Baran等人以高张力[1.1.1]螺桨烷6为原料,经单电子或双电子转移途径获得对称与不对称BCPs(图1c),该策略主要制备C1和/或C3取代的BCPs;2)构建C2取代BCPs骨架的策略,如Wurtz偶联、Norrish–Yang环化、[2 + 2]光环加成、环收缩以及扩环反应。然而,这些策略通常会存在底物范围受限以及产率较低等问题。因此,迫切需要开发一种快速高效的方法来构建多取代(C1、C2与C3)BCPs分子。
近日,美国德克萨斯大学西南医学中心的秦天教授课题组从硼酸酯取代的环丁酮出发,经分子内偶联成功地构建了一系列多取代BCPs(图1d),同时还制备了多种结构复杂的双环烷基硼酸酯,特别是桥头烷基硼酸酯还能进行后续的衍生化。如图1d所示,硼酸酯取代的环丁酮9与活化剂磺酰肼原位生成环丁烷连接的磺酰腙和硼酸酯,后者经碱介导的分子内偶联得到高活性的双环[2.1.1]两性离子中间体10,随后经1,2-金属酸盐重排、N2释放便可形成所需的BCP骨架11。相关成果发表在Nature Chemistry 上。
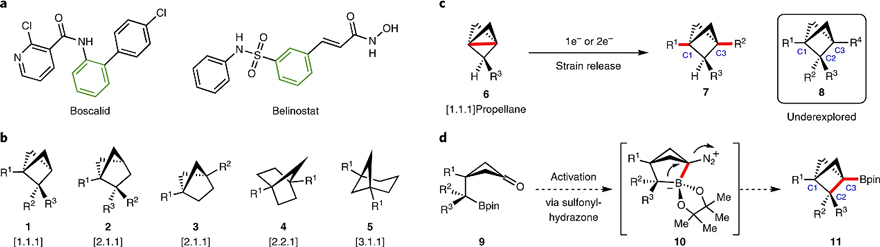
图1. 桥连烃和 BCP 合成。图片来源:Nat. Chem.
首先,作者从环丁基甲醛12出发,一步法制得关键中间体13,随后13原位形成腙并经先前报道的反应条件,初步实现了桥头Bpin取代的BCP产物14的合成(图2,entry 6)。接着,作者对磺酰肼、碱、溶剂和温度进行广泛的筛选后,最终确定了最佳条件:即在均三甲苯磺酰肼为活化剂、碳酸铯为碱和二恶烷为溶剂的条件下进行反应,能以83%的分离收率获得偶联产物14(图2,entry 1)。值得注意的是,该反应在空气下就可以顺利进行,并不需要惰性气氛(图2,entry 10)。
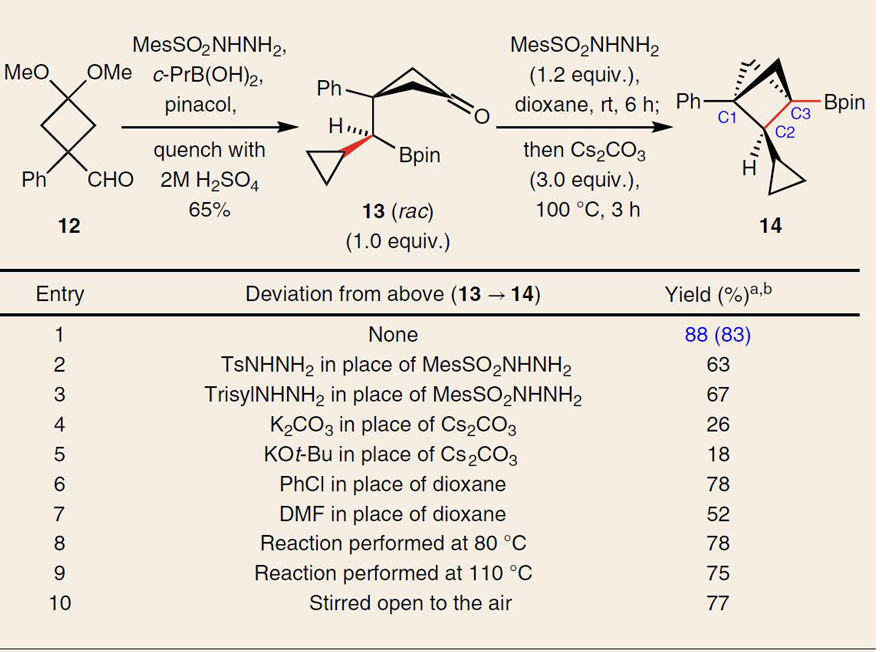
图2. 条件筛选。图片来源:Nat. Chem.
在最优条件下,作者考察了该反应的底物范围(图3)。假设环化会受到环丁烷9构象的影响,因此作者选择位阻较大的苯基(R1=Ph,A值=3.0)取代的环丁烷,对底物的适用性进行了探究,其中A值表示单取代环己烷中平伏取代与轴向取代的构象之比。如图3所示,伯烷基-Bpin(R2 = H,R3 = H)、仲烷基-Bpins甚至叔烷基-Bpins都能顺利地进行环化反应,分别得到C1、C3-二取代BCP-Bpin(16)、C1、C2、C3-三取代BCPs(14和17-23)以及C2位双取代BCPs(24和25),其中产物14和20还能以克级规模制备。对比BCP 16、20和26的单晶数据,作者发现C2取代基的增加会减小C1-C2-C3之间的夹角,这可能是由于Thorpe-Ingold效应。此外,该反应还能耐受多种官能团,例如:4-氯苯基(31)、2-噻吩基(27)、3-吡啶基(28)、甲基(A值= 1.7,29)、异丙基(A值= 2.1,30)、酰胺(32)、异丙酯(A值=1.2, 33)、乙烯基(A值=1.35, 35)、末端炔烃(A值= 0.41, 36)以及胺(34)等。需要指出的是,C2位-Bpin取代的底物也能兼容该反应,以中等的收率得到双Bpin-取代的BCPs分子(37和38)且能以克级规模进行制备。另外,从手性Bpin前体出发,也能以64%的收率获得手性BCP 39,并且手性保持不变。除了环丁烷侧链上的取代基(R2/R3)外,环骨架上C2位-甲基取代的环丁酮40也能以42%的收率转化为所需的环化产物17。
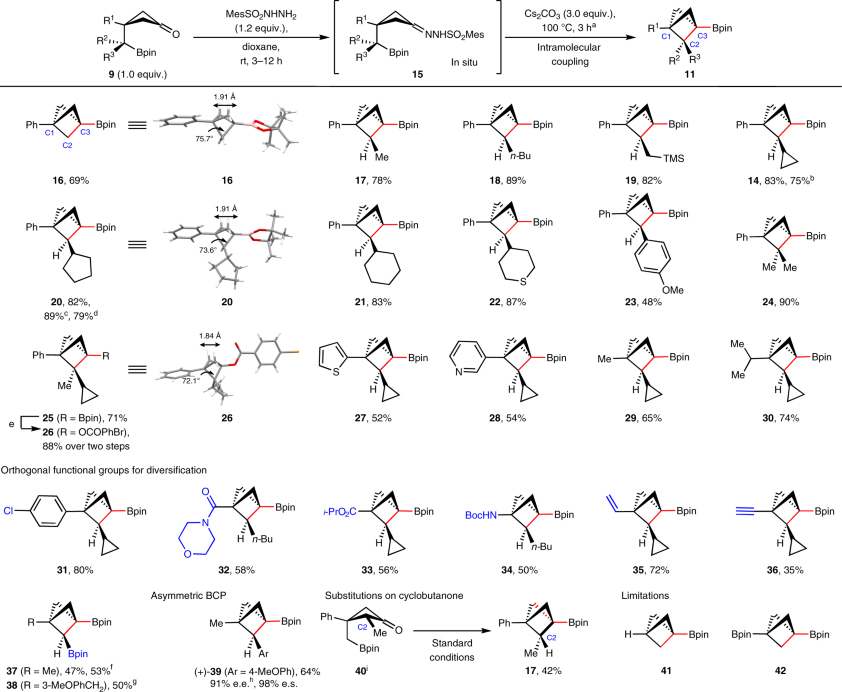
图3. 底物拓展。图片来源:Nat. Chem.
事实上,该策略的战略性在于能够将制备的C2-取代BCP-Bpins的模块化(通过交叉偶联)结合起来,并利用Bpin官能团化实现BCP分子桥头位置的官能团多样性(图4)。例如:1)硼酸酯20可以被氧化为醇43;2)也可以经Aggarwal 芳基化、Zweifel烯化反应和Matteson 同系化构建新的碳碳键44、45、46。此外,Bpin 基团也可以转化为更稳定的三氟硼酸盐 47,这为进一步官能团化提供了新的机遇。例如:1)47经自由基脱硼可以制备C1,C2-二取代 BCP分子48;2)经钯催化的Suzuki交叉偶联反应构建C(sp3)-C(sp2) 键49-51;3)原位生成的硼酸与磺酰腙52进行交叉偶联得到Bpin 53(收率:92%);4)47被BF3•Et2O活化后,能与烷基叠氮化物进行胺化反应,以中等的收率得到胺54-56。此外,化合物57是一种治疗失眠的食欲素受体拮抗剂,而且其结构中含有1,3,4-三取代苯环,但之前获取官能团化BCPs的方法却不利于制备饱和三取代BCP类似物。相比之下,该方法通过环丙基安装(59)、环化(33)、Bpin氧化成醇和烷基化(60)等步骤即可快速高效地获得饱和三取代BCP分子(图4b),进一步体现了该方法的实用性。
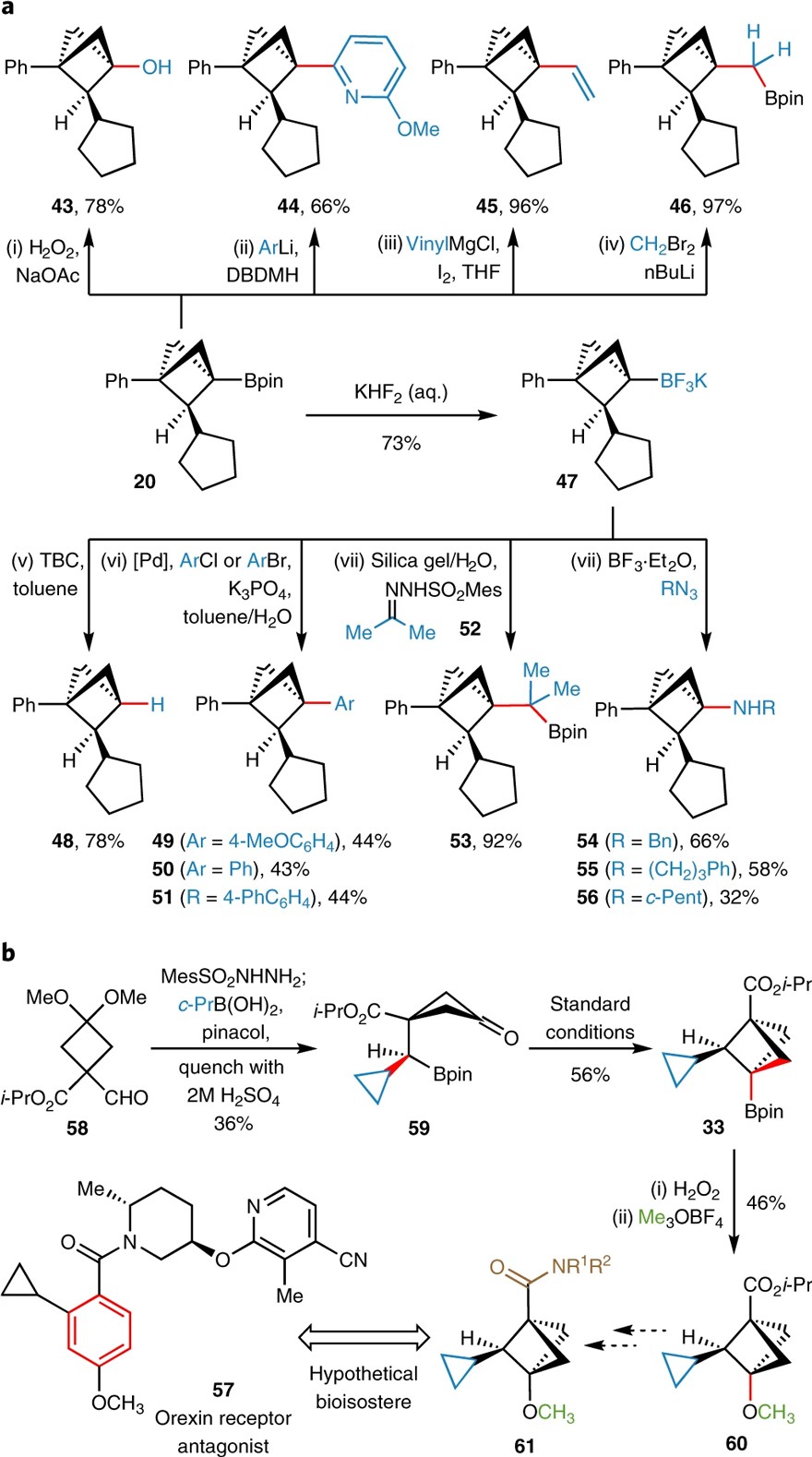
图4. 合成应用。图片来源:Nat. Chem.
类似地,该策略还能构建其它饱和生物电子等排体的双环骨架,从而获得桥头位置Bpin保留的双环体系。如图5所示,从一系列环丁酮(64-66、70)、环戊酮(72和73)、环己酮(76、78和80)以及氮杂环己酮(82)出发,成功地制备了相应的双环[2.1.1](67-69和71)、[2.2.1](74、75和77)、[3.1.1](79)、[3.2.1](81、83)体系。另外,手性环丁酮-Bpin 70同样能兼容该反应,以良好的收率得到手性[2.1.1]双环产物71且对映选择性保持不变,使得有价值的生物电子等排体的不对称合成成为了可能。
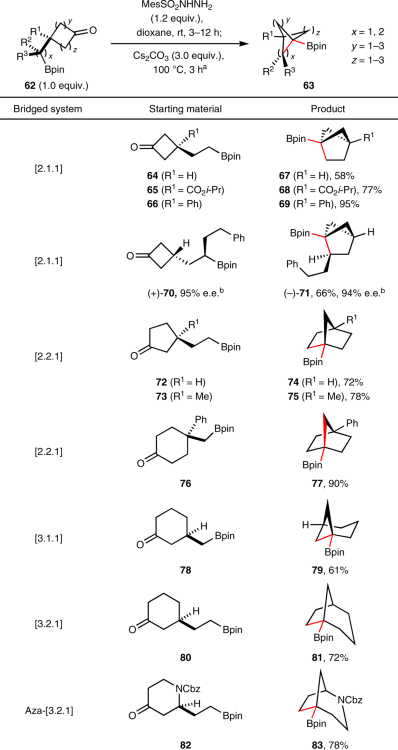
图5. 双环系统的构建。图片来源:Nat. Chem.
总结
秦天教授开发了一种分子内环化反应来制备C1、C2和C3-取代的 BCPs分子。该策略不仅具有操作简单、化学选择性好等优势,而且能够快速、模块化地制备一系列具有挑战性的BCP-Bpins分子。此外,该方法已成功制备了一系列目前尚未被完全探索的药物相关的双环生物电子等排体。可以预见,该方法将会对药物研发产生重大影响,特别是在苯替代物的设计和合成等方面。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

An intramolecular coupling approach to alkyl bioisosteres for the synthesis of multisubstituted bicycloalkyl boronates
Yangyang Yang, Jet Tsien, Jonathan M. E. Hughes, Byron K. Peters, Rohan R. Merchant, Tian Qin
Nat. Chem., 2021, 13, 950-955, DOI: 10.1038/s41557-021-00786-z
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号