Nat Commun|李蔚、史偈君等开发计算生物学方法衡量DNA甲基化/去甲基化的拮抗作用,并揭示其为抑癌基因分子标记
DNA胞嘧啶甲基化是一种可逆的表观遗传修饰,参与调控基因表达和染色质开放程度,广泛影响个体发育、癌症发生和衰老等生物学过程。哺乳动物甲基化组 (methylome) 由两个相互拮抗的生物学作用共同形成,即 DNA 甲基转移酶 DNMT 介导的甲基化 (methylation) 和TET双加氧酶介导的去甲基化 (demethylation)。这两个酶家族在DNA上的结合呈现竞争模式[1],敲降Dnmt3a后TET1蛋白在基因启动子区域(promoter)的结合增强,反之亦然 [2]。前人研究表明,Dnmt3a & Tet2 双敲除小鼠的存活率低于Dnmt3a或Tet2单敲除小鼠 [3]。并且,在人类 T 细胞淋巴瘤中, DNMT3A 和 TET2 的突变呈现显著的并存 [4]。这些发现表明甲基化和去甲基化过程的并发与肿瘤发生密切相关。然而,目前没有方法能够衡量两者的并发,其与基因表达的关联也未被揭示。
近日,来自美国加州大学尔湾分校李蔚教授团队的史偈君等研究人员在Nature Communications 杂志发表文章,开发了基于亚硫酸氢盐测序 (bisulfite-seq) 的计算生物学方法——甲基化并发率 (methylation concurrence ratio),能够衡量甲基化和去甲基化过程在基因调控元件上的拮抗作用,具有不同于传统平均甲基化 (average methylation ratio) 的生物学特性,并可作为抑癌基因的新型表观遗传分子标记。

自甲基化测序方法面世以来,DNA 甲基化水平一直以“平均”的方式进行量化,但这种方法无法刻画甲基化的局部变异。如图1a所示,虽然两个例子的甲基化模式存在明显差异,但平均甲基化却都是0.5。Example 2中存在较多的不完全甲基化片段,在这些片段上可能同时存在甲基化与去甲基化作用。因此,研究人员将不完全甲基化片段中的未甲基化CpG定义为“甲基化并发CpG”(图1b中红色所示),甲基化并发率即为并发CpG的比率。如图1b所示,与平均甲基化相比,甲基化并发率对甲基化模式的局部变异更加敏感。研究人员分析了DNMT 和 TET 酶的ChIP-seq数据,并定义了基因启动子区的“DNMT-TET共结合指数”。该指标越大,表明DNMT 和 TET 酶在启动子区的共结合效应越强;反之,若该指标为0,则表明两者不存在共结合。该共结合指数与甲基化并发率之间存在显著的正相关性(Spearman’s r = 0.47,图1d),而与平均甲基化的相关性并不显著(图1c)。这表明甲基化并发率可以刻画DNMT 和 TET 酶的共结合,而平均甲基化则不能。
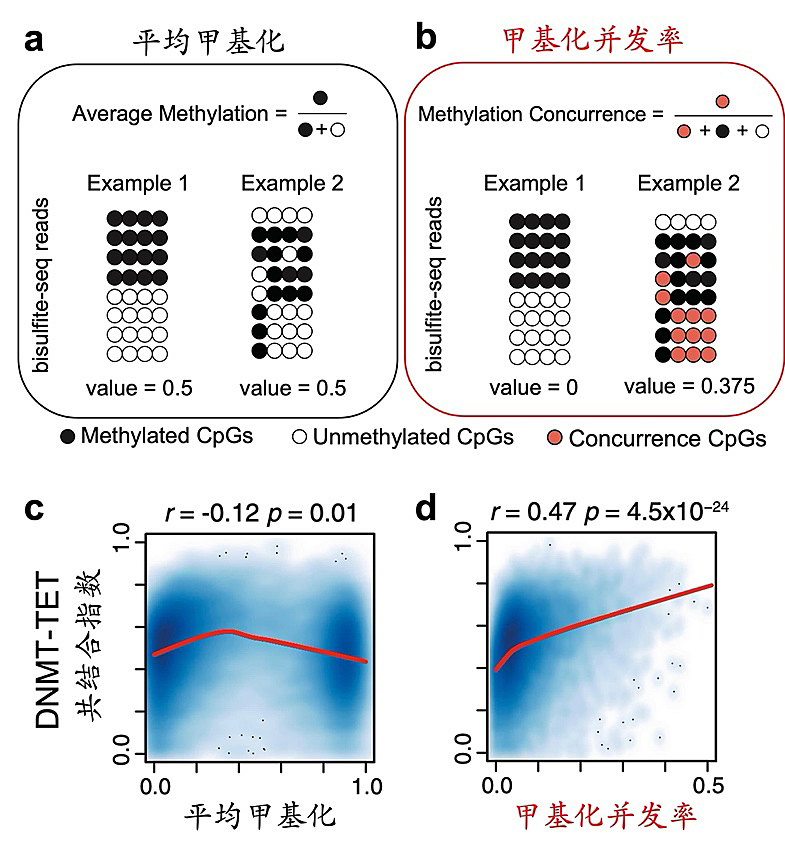
图1. 平均甲基化与甲基化并发率方法的比较
虽然平均甲基化方法已被广泛使用,但其与基因表达的关系仍不完全明确。目前普遍认为启动子区CpG岛(CpG island)的平均甲基化与基因表达水平呈负相关,但是基因体区域(gene-body)和增强子区域(enhancer)的平均甲基化与基因表达的关系仍存在争议。本研究发现,不同类型调控元件的平均甲基化与基因表达水平的相关性不尽相同。而甲基化并发率能够更好的指示基因表达水平,不论哪一种基因调控元件(例如启动子、基因体和增强子)上的甲基化并发率始终与基因表达呈现较强的负相关性。之后,研究人员发现抑癌基因在正常样本中的甲基化并发率水平很低,并且该现象在不同组织中高度保守。通过分析TCGA中多种癌症(子宫肌瘤,乳腺癌等)样本的甲基化组,进而发现肿瘤中甲基化并发率的升高与 40~60% 的抑癌基因表达下调有关,而这些基因的平均甲基化却未发生改变。总之,本研究提出了甲基化并发率这一新型甲基化量度方法,强调了甲基化局部变化对基因表达的显著影响,拓展了我们对肿瘤异常甲基化模式的理解。
文章的第一作者为史偈君博士,通讯作者为李蔚教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

The concurrence of DNA methylation and demethylation is associated with transcription regulation
Jiejun Shi, Jianfeng Xu, Yiling Elaine Chen, Jason Sheng Li, Ya Cui, Lanlan Shen, Jingyi Jessica Li & Wei Li
Nat. Commun., 2021, 12, 5285, DOI: 10.1038/s41467-021-25521-7
参考文献:
1. Charlton, J. et al. TETs compete with DNMT3 activity in pluripotent cells at thousands of methylated somatic enhancers. Nat. Genet., 2020, 52, 819–827, DOI: 10.1038/s41588-020-0639-9
2. Gu, T. et al. DNMT3A and TET1 cooperate to regulate promoter epigenetic landscapes in mouse embryonic stem cells. Genome Biol., 2018, 19, 88
3. Zhang, X. et al. DNMT3A and TET2 compete and cooperate to repress lineage-specific transcription factors in hematopoietic stem cells. Nat. Genet., 2016, 48, 1014-1023
4. Couronné, L., Bastard, C. & Bernard, O. A. TET2 and DNMT3A mutations in human T-cell lymphoma. New Engl. J. Med., 2012, 366, 95
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号