拉曼“热点”可见可控,无序蛋白分子逐个探究
天然无序蛋白具有独特的结构特点,参与许多重要的生理与病理过程,还与一些神经退行性疾病的发生和发展有着密切联系。其中,α-突触核蛋白(α-Syn)的单体在自然状态中不形成稳定的蛋白质二级结构,而是自发地从某一种二级结构转变为另一种二级结构。有些情况下,α-突触核蛋白从一些不太稳定的低聚体转化成不可逆转的蛋白聚集物,呈现出符合帕金森综合征病理学的症状。因此,研究这些中间状态的α-突触核蛋白分子,可以帮助我们更好地从分子层面上理解帕金森综合征的发展机制。但是,这些少量的中间状态的α-突触核蛋白分子和大量的自然状态的蛋白单体共存于一个动态转化的混合体系中,很难被传统的大体量检测方法观察到,因为它们独特、微弱、瞬态的信号在高检测浓度和长采样时间的测量中被平均化处理而掩盖了。所以,需要发展一种新的分子检测方法,能从大体量的混合体系中灵敏地捕捉到少量分子的信息,这对于研究无序蛋白的结构及其动态转变具有重要的意义,还将为相关神经退行性疾病的分子机制研究提供新的信息。
表面增强拉曼光谱(SERS)具有灵敏度高、快速无损、水环境兼容性好等特点,非常适合用于生理浓度下蛋白分子构象的实时检测。其拉曼信号的增强主要得益于纳米基底材料的表面等离激元效应,在入射光作用下激发的局域表面等离激元共振使基底周围的电磁场得到极大的增强,从而增强待测物的拉曼信号。其中,具有显著增强效应的空间区域称为“热点”区域(hotspot)。构建灵敏度高、稳定性好、“热点”易于调控的基底材料是SERS技术研究的关键,也是应用在蛋白分子快速、有效、高通量结构分析的前提基础。最近,香港科技大学和香港大学的团队提出了一种新颖的双光镊与表面增强拉曼光谱联用的检测平台,构建出可见可控的“热点”,实现了在生理浓度下对各种α-突触核蛋白动态结构的实时检测。
图1. 光镊联合拉曼光谱监测体系的概念图。
研究团队首先将纳米银颗粒附着在微米级的二氧化硅小球表面,并借助双光镊系统在微流控流体通道中对小球实施捕获和操控,从而在两个小球之间构建出可视化、可调控的“热点”来探测水溶液中待测物的SERS信号(图2),还能达到单分子级别的灵敏度。利用双光镊系统对两个小球的位置进行操控,可以实时调整“热点”区域的尺寸及拉曼信号的增强倍率,使得蛋白分子能够自由进出“热点”区域,在获得足够蛋白信号增强倍率的同时避免激光对蛋白分子自然结构的破坏。此外,将样品溶液通道连接到微流控系统中,有利于减少蛋白分子与小球的接触,降低热效应,进一步保持天然无序蛋白分子的结构特性不受到探测的影响。
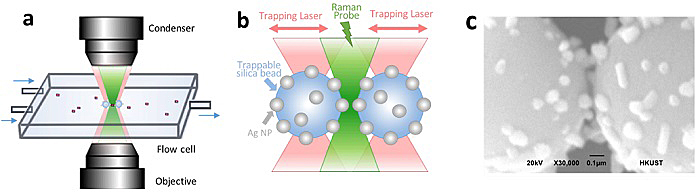
图2:(a) 微流控流体通道中的光镊联用拉曼光谱监测体系。(b),(c)“热点”区域 (hotspot)示意图。图片来源:Nat. Commun.
研究团队表征了在生理浓度(1 μM)下的α-突触核蛋白,发现这些低浓度拉曼光谱呈现出了与以往高浓度拉曼光谱不同的峰位特征。在200张平行采集的1 μM α-突触核蛋白SERS谱图中,除了大量存在的无规卷曲构象外(特征峰为酰胺I带1671 cm-1),还有少量蛋白分子以α-螺旋(特征峰为酰胺I带1653 cm-1)或β-折叠(特征峰为酰胺I带1664 cm-1)的中间状态存在(图3)。这些α-突触核蛋白的瞬态二级结构,可能会对进一步的蛋白聚集起到决定性作用。由此可见,这个新颖的双光镊与表面增强拉曼光谱联用的检测平台可以在复杂的样品体系中只探测少量的蛋白分子,减少在数量和时间上大量信号平均所导致的稀少结构信号缺失,从而捕捉到少量的处于中间状态的α-突触核蛋白的结构信息,为深入理解无序蛋白经过渡态转变为聚集体的过程机制提供了更多的信息和依据。此外,双光镊与表面增强拉曼光谱技术的结合不仅能提高SERS检测的灵敏度、稳定性和可重复性,还能在“热点”区域进行亚纳米级的空间调节以及亚皮牛顿级的受力测量,为进行更精密的单分子操控和单分子定点表征提供更多的可能性。
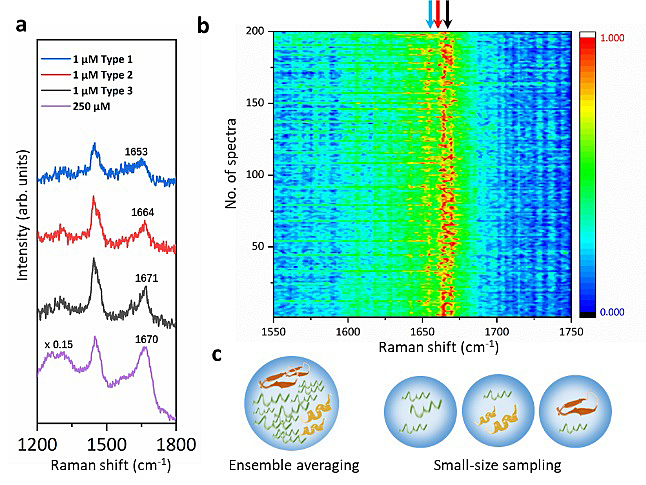
图3:(a),(b) α-突触核蛋白过渡态分子在拉曼光谱中所呈现出的结构变化信号。(c)传统检测手段信号平均与单分子检测系统对稀少信号捕捉的对比示意图。图片来源:Nat. Commun.
这项工作近期发表于综合科学期刊Nature Communications 上,文章的第一作者是香港科技大学博士Dai Xin,共同通讯作者分布是香港大学研究助理教授Liu Wei和香港科技大学助理教授Huang Jinqing。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Optical tweezers-controlled hotspot for sensitive and reproducible surface-enhanced Raman spectroscopy characterization of native protein structures
Xin Dai, Wenhao Fu, Huanyu Chi, Vince St. Dollente Mesias, Hongni Zhu, Cheuk Wai Leung, Wei Liu & Jinqing Huang
Nat. Commun., 2021, 12, 1292, DOI: 10.1038/s41467-021-21543-3
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号