祝介平团队Nat. Chem.:C-C键活化新策略
金属催化的碳-碳(C-C)键活化可以说是一个颇为棘手的课题,一方面归因于C-C键的动力学惰性,另一方面要归因于碳-金属键相对较弱。目前报道的C-C键活化方法主要通过具有环张力的C-C键对低价金属氧化加成形成环金属物种,涉及小环的环张力释放来补偿反应在动力学和热力学上的不利因素。除此以外的金属催化C-C键活化通用策略还很少见。1972年,Reetz教授首次提出了dyotropic重排反应(Angew. Chem. Int. Ed., 1972, 11, 129-130;Angew. Chem. Int. Ed., 1972, 11, 130-131),即两个σ键同时在分子内进行迁移。在过去的40年里,金属参与的dyotropic重排反应得到了巨大的进展,但是大多数反应都需要碳-金属键作为支撑,因此需要化学计量的金属参与反应(图1a)。为了解决这一问题,化学家发展了1,2-Pd迁移(即β-H消除、再次插入),并在有机合成中得到了广泛的应用。另一方面,尽管已经发展了钯催化烯烃的对映选择性1,2-和1,1-芳基氟化反应以及色烯的1,3-芳基氟化反应,但是这些反应仅限于构建含有C-F键的三级立体中心,这是因为季碳C(sp3)-Pd物种的生成极具挑战性。
瑞士洛桑联邦理工学院(EPFL)的祝介平教授(点击查看介绍)课题组设想能否利用1,2-烷基(芳基)/Pd的dyotropic重排反应来构建季碳C(sp3)-Pd物种(图1b)。这是因为该过程在断裂未活化C-C σ键的同时生成了新的C-C σ键和C-Pd键,这不仅有利于后续的官能团化,而且与传统的syn-β-C消除/C-Pd化机理完全不同(图1c)。近日,他们在温和的条件下立体定向地实现了邻位C-C键和C-Pd(IV)键的dyotropic重排,构建了一系列含有三个立体中心的氟化环戊烷。具体而言,底物1与原位生成的ArPdX物种在酰胺的导向下生成中间体A,后者经β-H消除、再次插入异构化为中间体B,其中酰胺基团和Pd形成的五元螯合物为Pd-迁移提供了驱动力。接着,Pd(II)物种B被Selectfluor(4)氧化为Pd(IV)物种C,然后进行dyotropic重排便可得到中间体D,后者能以η3-络合物E的形式存在。最后,中间体D经还原消除便可得到目标产物2。相关成果发表在Nature Chemistry 上。
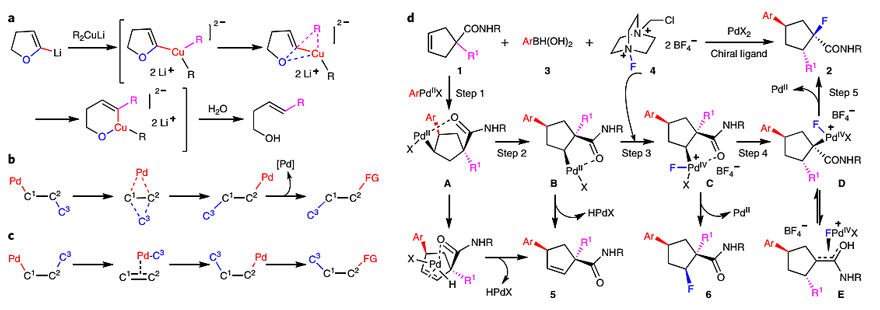
图1. 涉及金属的Dyotropic重排。图片来源:Nat. Chem.
首先,作者选择环戊烯1a(R = R1= Ph)为模板底物、3-甲氧基苯基硼酸(3a)为偶联试剂、Selectfluor(4)为氧化剂和氟源在二氯乙烷(DCE)中进行反应,经过一系列筛选,发现在催化量Pd(OAc)2和4,4'-二叔丁基-2,2'-联吡啶(L1)的作用下,能以70%的收率得到单一的非对映异构体(±)-2a。随后,作者尝试对映选择性合成并筛选了各种反应参数(如手性配体、钯源、碱、溶剂、添加剂以及F+源),并得到了最佳反应条件:即1a、3a和4在Pd(AdCO2)2(10 mol%)为催化剂、L2(12 mol%)为配体、Na2CO3(3.0当量)为碱、AdCO2H(1.0当量)为添加剂、DCE为溶剂的条件下于50 ℃和Ar气氛下进行反应,能以70%的收率、92%的e.e.值得到所需产物2a(图2)。值得一提的是,当使用Pd(OAc)2为预催化剂在标准条件下进行反应时,2a的e.e.值基本不变但是收率却大大降低(47%),这表明作为Pd(II)抗衡离子的大位阻金刚烷-1-羧酸盐(AdCOO-)对于2a的生成至关重要。
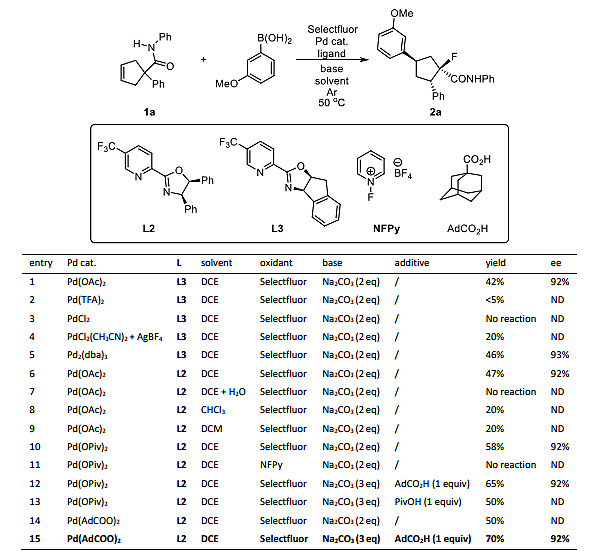
图2. 反应条件优化。图片来源:Nat. Chem.
在最优条件下,作者考察了该反应的底物范围(图3)。对于芳基硼酸而言,无论是带有供电子基团还是吸电子基团均能有效地参与该反应,以中等至较好的收率(43-76%)和优异的对映选择性(83-93% e.e.值)得到所需产物(2a-2m),其中2a和2d的相对和绝对立体化学已通过X-射线衍射分析确定。值得一提的是,1a还能以1 mmol规模进行反应,以61%的收率和93% e.e.值得到2a。其次,作者考察了酰胺的底物范围,结果显示衍生自官能化(如Cl、CO2Me、Me)苯胺的酰胺都能兼容该反应(2n-2r),尽管2-甲基苯胺衍生的酰胺(2p)的对映选择性较低。最后,作者考察了迁移基团的底物范围。正如预期所示,迁移基团对反应结果(特别是反应收率)产生了巨大影响(2s-2z)。有趣的是,甲基和甲氧基也能参与迁移过程并得到产物2y和2z,尽管收率很低。需要指出的是,所有反应中仅分离出一种非对映异构体。
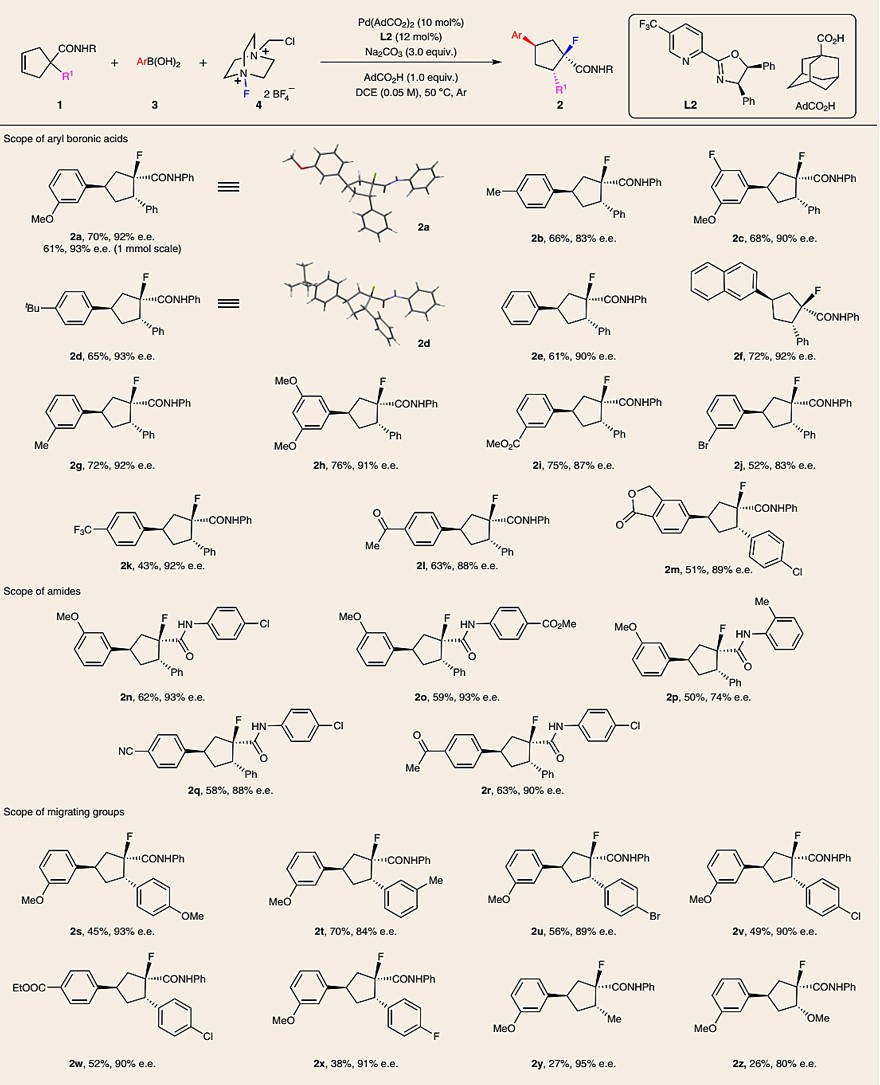
图3. 底物拓展(一)。图片来源:Nat. Chem.
鉴于在最优条件下未观察到β-H消除产物5,而是形成了副产物1,3-氟芳基化产物6。因此作者分离出副产物6s、6y和6z,并分别进行了表征(图4a)。如图4b所示,副产物6s有两种可能的生成途径,即Pd(IV)物种C的还原消除(Path a)和F-对中间体F上Cβ处进行的区域选择性开环(Path b)。尽管F-对中间体F上Cα处的亲核进攻也能解释产物2s的形成,但这不太合理,因为空间效应和电子效应均有利于Cβ处的进攻。相比之下,作者认为通过过渡态G将中间体C转变为中间体D的I型dyotropic重排或许更合理(Path c),这也与化合物2中4-芳基和酰胺的相对立体化学(trans)相一致。
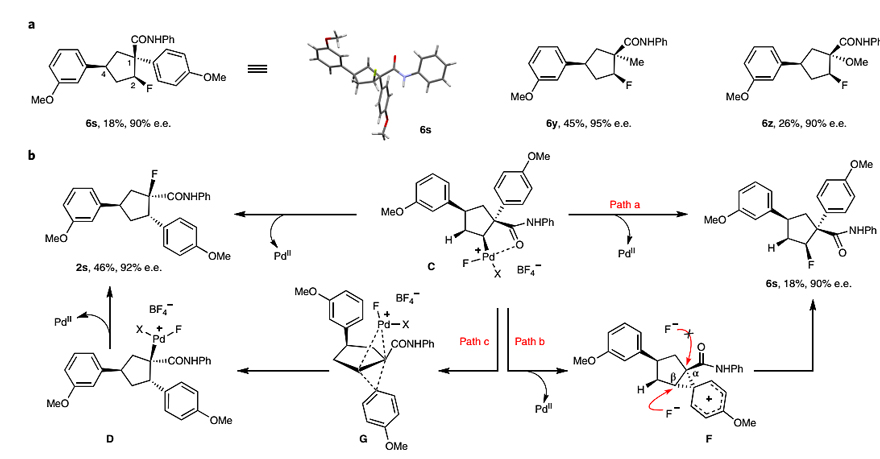
图4. 反应副产物和反应机理。图片来源:Nat. Chem.
如图5a所示,作者将1a、芳基硼酸3与化学计量的Pd(OAc)2和配体L1在DCE中进行反应,分离出两种稳定的Pd(II)络合物(±)-7a和(±)-7b。随后,作者将(±)-7a、Selectfluor和Na2CO3置于DCE中于50 ℃下进行反应,分别以38%和21%的收率得到(±)-2l和(±)-6l(图5b),并且高分辨质谱(HRMS)分析检测到PdF(IV)+中间体8a或9a的存在,这表明Pd(IV)+物种的dyotropic重排和还原消除在动力学上都有利。然而,由于添加外部氟源(如NaF、TBAF或TBAT)对反应结果并没有影响,因此作者推测6l和2l分别是通过五配位Pd(IV)+物种8a和9a的C-F键还原消除形成的。此外,当(±)-7a在有/无碱的条件下进行反应时,只会导致底物部分分解,因此作者推测是Pd(IV)物种经历了面部dyotropic重排而非Pd(II)物种。最后,作者将(±)-7a置于单电子(SET)氧化剂(如PhICl2、Ce(SO4)2、[Cp2Fe] PF6)下进行反应时(图3c),以低至中等的收率得到烯烃5l,并且未观察到dyotropic重排产物,从而排除了Pd(III)物种的可能性。然而,由于目前尚未分离出Pd(IV)中间体9a并对其进行表征,因此无法排除其它机制的可能性。
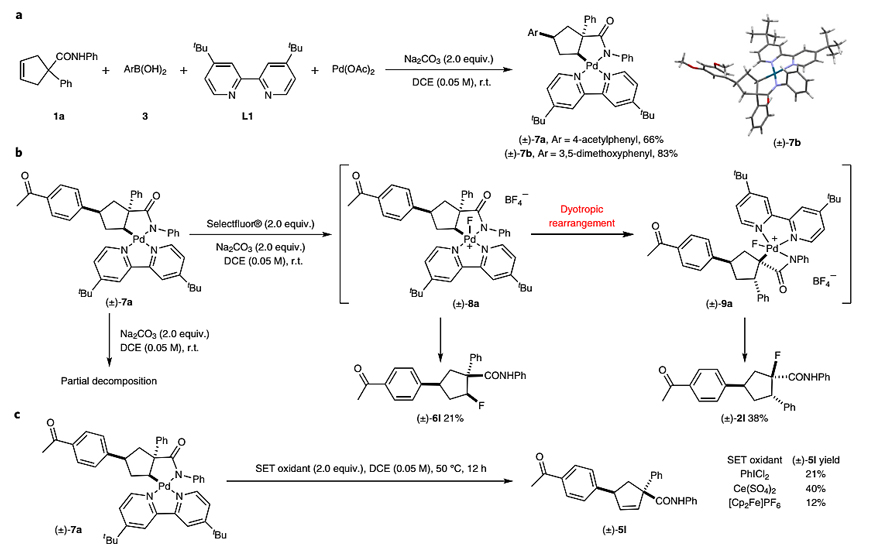
图5. 反应关键中间体的结构表征。图片来源:Nat. Chem.
鉴于富电子的吲哚-3-硼酸反应效果较差,因此作者尝试将2-炔基苯胺10与环戊烯1a在Selectfluor(4)的存在下进行环化交叉偶联反应(图6)。不走运的是,在标准反应条件下目标产物11的收率很低。为此,作者对反应条件进行优化,并最终得到了最优条件:即1a/10/4 = 1:1.3:1.5、Pd(OAc)2(10 mol%)、L2(12 mol%)、DCE(0.05 M)、50 ℃和氩气气氛,能以中等的收率(35-46%)和较好的对映选择性(76%-90% e.e.值)得到所需产物(11a-11d)。需要指出的是,该过程是一个高度有序的多米诺序列,包括氨基钯化/碳钯化/β-H消除/再次插入/1,2-芳基(烷基)/Pd(IV) dyotropic重排/还原性C-F键形成,这意味着该过程同时生成了四个化学键(即两个C-C键、一个C-N键和一个C-F键)。
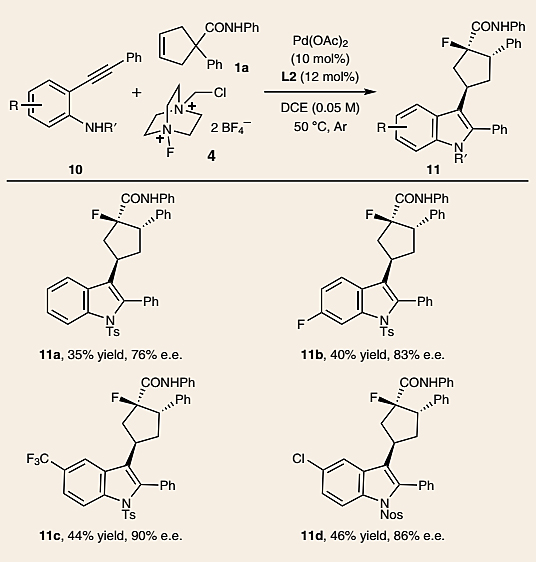
图6. 底物拓展(二)。图片来源:Nat. Chem.
总结
祝介平教授课题组通过1,2-芳基(烷基)/Pd的dyotropic重排,将前手性环戊烯转化为含有三个立体中心的手性含氟环戊烷,其中包括一个C-F键的季碳立体中心。此外,作者还将该重排过程与过渡金属催化的环化偶联反应相结合,高对映选择性地合成了吲哚取代的手性含氟环戊烷。该重排过程不仅为C-C键活化提供了一种新思路,而且为Pd催化的其它转化提供一个新工具。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

C-C bond activation enabled by dyotropic rearrangement of Pd(IV) species
Jian Cao , Hua Wu, Qian Wang, Jieping Zhu
Nat. Chem., 2021, DOI: 10.1038/s41557-021-00698-y
导师介绍
祝介平
https://www.x-mol.com/university/faculty/2766
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号