JACS:从细胞外到细胞内的生物启发细胞硅化
在自然界中,生物硅化作用帮助硅藻在温和条件下以制造多级有序且化学惰性的二氧化硅装甲。无机装甲的存在不仅为硅藻柔软的内部提供机械支撑,还增强其化学稳定性和热稳定性,并赋予其抵抗微生物侵袭的能力。值得注意的是,这一独特的二氧化硅外骨骼并不会影响硅藻对光的吸收,并且也不会对其养分吸收或废物交换产生不利影响。上述二氧化硅壳层优异的特性激发了仿生领域研究工作者的极大兴趣,旨在将细胞固定在这些精巧的二氧化硅纳米结构中,以保护它们免受有害的外部压力,并通过对二氧化硅的功能化修饰赋予其非内源性甚至非生物性的额外特性。
近期,美国新墨西哥大学C. Jeffrey Brinker院士、郭佶慜博士以及华南理工大学朱伟教授团队联合在Journal of the American Chemical Society 上发表题为“Bioinspired Cell Silicification: From Extracellular to Intracellular”的前瞻性论文,系统评述了生物启发细胞硅化的研究进展,以多细胞二氧化硅基质包裹(Cell-in-Silica Matrix)、单细胞二氧化硅外骨骼包裹(Cell-in-Silica Shell)和无定形二氧化硅“冰冻”细胞(Cell Frozen-in-Silica)三种策略展开介绍,集中讨论了仿生细胞硅化的发展及其伴随的挑战,并就仿生细胞硅化的合成-结构-性能之间关系的提供了独特的见解。华南理工大学雷琪博士和新墨西哥大学郭佶慜博士为共同第一作者。同时,谨以此文,献给Sol-Gel先驱C. Jeffrey Brinker院士,祝其70岁生日快乐。
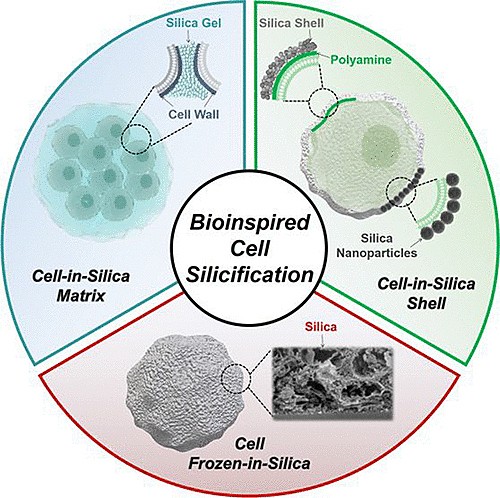
图1. 仿生细胞硅化策略
1. 多细胞二氧化硅基质包裹(Cell-in-Silica Matrix)
早在1989年,Carturan等人就采用传统的溶胶-凝胶方法(Conventional Sol−Gel Approach),开创了多细胞二氧化硅基质包裹。然而,传统的醇盐基二氧化硅溶胶-凝胶的加工往往会导致细胞损伤。如何提高生物相容性,降低细胞毒性成为了当时的研究重点。细胞诱导自组装(Cell-Directed Assembly Approach,CDA)方法,因为采用了生物相容的短链两性离子磷脂,替代传统对细胞具有细胞毒性的表面活性剂,并通过蒸发诱导自组装(EISA)方式介导有序脂质/二氧化硅结构对细胞进行封装,首次实现了活细菌或酵母细胞的长期干燥保存。此后,这一生物相容性的细胞包裹策略被不断改良。值得注意的是,研究发现CDA自组装策略还可以进一步诱导包裹的细菌细胞进入休眠潜伏状态,这使得工业级别诱导潜伏状态细菌成为可能,并对于研究细菌复苏和筛选靶向潜伏性细菌(如结核病)药物提供了良好平台。这一研究开辟了硅基质诱导生物学行为(Biological Behaviors Induced by the Silica Matrix)的新方向。
2. 单细胞二氧化硅外骨骼包裹(Cell-in-Silica Shell)
由于固定和操纵单个细胞有利于生物传感器和生物反应器的开发以及细胞生物学的研究,人们从多细胞二氧化硅基质包裹转向了单细胞二氧化硅包裹。然而如何精确的将单细胞封装在二氧化硅外骨骼中是当时面临的挑战。2009年,聚胺介导硅化技术(Polyamine-Mediated Silicification)首次实现了单细胞封装。此后,单细胞硅化的研究如雨后春笋般出现。然而这些研究大多只强调保护活细胞免受外部有害压力,极少有通过二氧化硅壳层功能化(Functionalization of the Silica Shell)赋予包封细胞以非内源性甚至非生物性的特性。基于此,以二氧化硅纳米粒子为功能壳层对单细胞进行表面修饰和功能化衍生的策略(Nanoparticle-Based Shell Formation)被提出,通过多种功能化纳米粒子的组装,实现了对动物细胞非生物特性及功能的赋予,拓展其在生物医学领域中的应用。
3. 无定形二氧化硅“冰冻”单细胞(Cell Frozen-in-Silica)
之前的细胞硅化仅能提供细胞外保护,无法有效保护对细胞内成分。这促使人们思考是否可以将细胞整个“冰冻”在类似无定形冰的二氧化硅基质中,达到细胞内外成分的固定及保护,以提供一种可以与冷冻保存相媲美的室温保存方法。就此,作者首先探讨了细胞内/细胞外硅化的概念与机制(Concept and Mechanism of Intra/Extra- Cellular Silicification),之后对无定形二氧化硅“冰冻”单细胞或细胞硅化复制体(Silica Cell Replication)进行了详述,并对其生物医学领域中的应用(Silica Cell Replica-Based Biomedical Applications)进行了讨论。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Bioinspired Cell Silicification: From Extracellular to Intracellular
Qi Lei, Jimin Guo*, Fanhui Kong, Jiangfan Cao, Lu Wang, Wei Zhu*, and C. Jeffrey Brinker*
J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.1c00814
通讯作者介绍

郭佶慜博士,师从C. Jeffrey Brinker院士,现为新墨西哥大学-微工程材料中心,化学与生物工程系,以及新墨西哥大学健康科学中心-分子医学系的联合博士后研究员。主要研究方向为生物/材料界面相互作用,生物硅化及其生物医学应用。已在国际学术期刊Adv. Mater.,JACS,Adv. Funct. Mater.,ACS Nano等发表学术论文19篇,获授权中国发明专利7项、美国专利1项、PCT专利5项。

朱伟教授为华南理工大学生物科学与工程学院教授,博士生导师,国家海外青年高层次人才,“珠江人才计划”青年拔尖人才,华南理工大学“兴华精英学者计划”入选者。主要围绕材料与生物的结合开展前沿交叉探索,实现多学科交叉融合,发展基于材料强化的未来型人工生物体系。已在化学、纳米材料、传感等领域多个国际知名杂志如J. Am. Chem. Soc., Adv. Mater., Nano Lett., ACS Nano, Adv. Funct. Mater.等国际权威科学学术期刊上发表学术论文60余篇,论文总被引超过3500次。
https://www.x-mol.com/university/faculty/76146

C. Jeffrey Brinker教授为新墨西哥大学荣誉教授,美国国家工程院院士,美国艺术与科学院院士,美国国家发明家科学院院士,ACS Nano副主编。已发表论文400余篇,拥有美国专利50余项,H-Index为101,文章引用总数超过61000次。Brinker教授是“溶胶-凝胶”技术的先驱者,他将溶胶-凝胶加工与分子自组装相结合,创造出用于能源和人体健康的新型纳米材料,曾荣获溶胶凝胶科学与技术终生成就奖。
https://www.x-mol.com/university/faculty/215035
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号