α-手性叔碳的合成再添新方法
α-手性叔碳是一类重要的结构单元,广泛存在于天然产物和药物分子中。然而,要想合成这类手性结构仍颇具挑战,主要难点在于羰基α-位存在活泼氢,容易烯醇互变导致消旋化。自Buchwald和Hartwig报道钯催化的羰基化合物的α-芳基化反应以来,过渡金属催化的不对称α-芳基化反应便成为构建手性α-芳基酮/醛/酯的重要手段,目前针对该领域的研究已有几例报道,其中采用的策略各有千秋。譬如,周建荣课题组预先将酯转化为烯基硅醚,避免了强碱的使用及随后的消旋化,从而实现了酯的α-位手性叔碳的对映选择性合成(图1A,J. Am. Chem. Soc., 2011, 133, 15882)。Gaunt和MacMillan课题组近乎同期发表了铜催化、二芳基碘鎓盐参与的不对称α-芳基化反应,并且都选择使用酰亚胺的烯醇硅醚作为反应前体(图1B,J. Am. Chem. Soc., 2011, 133, 13778; J. Am. Chem. Soc., 2011, 133, 13782)。此外,MacMillan课题组又将底物拓展到无需预活化的醛,在CuBr和二芳基碘鎓盐的存在下,利用烯胺催化的策略实现了酯α-位手性叔碳的不对称合成(图1C,J. Am. Chem. Soc., 2011, 133, 4260)。
2013年,周建荣课题组发展了钯催化、芳基甲磺酸酯参与的α-芳基化反应,通过原位生成高亲核性的锡试剂,实现了α-芳基萘酮的高效不对称合成(图1D,Angew. Chem. Int. Ed., 2013, 52, 4906)。但是,该反应仅限于环状酮的α-芳基化反应,而有关非环状酮的α-芳基化反应却鲜有报道。近日,意大利帕多瓦大学的Manuel Orlandi教授研究团队发展了新型Cu(I)/轴手性双膦二氧化物的催化体系,实现了非环状酮类底物的不对称α-芳基化反应(图1E)。相关结果发表在J. Am. Chem. Soc. 上。
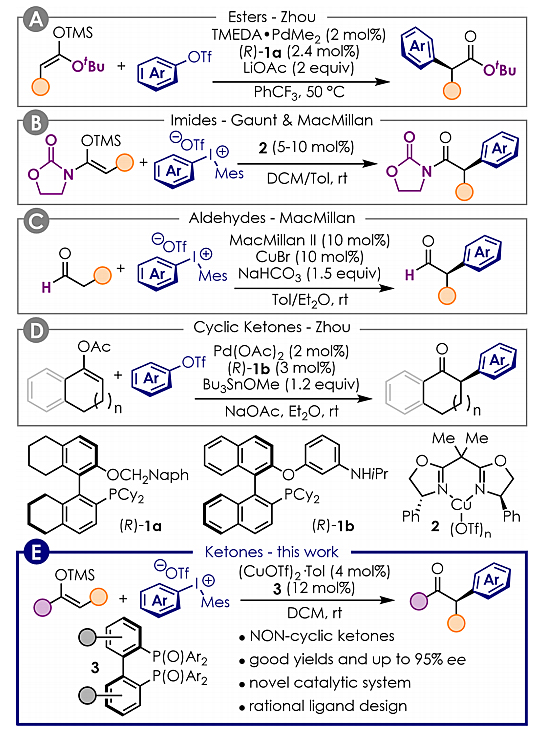
图1. 羰基化合物的不对称α-芳基化反应合成α-手性叔碳。图片来源:J. Am. Chem. Soc.
首先,作者选择烯醇硅醚4a和二芳基碘鎓盐5a为模板底物对反应条件进行了优化(图2)。在Cu(OTf)2的催化下,能够得到消旋的α-芳基化产物6a。在不对称反应的探究中,他们发现在有氧的条件下添加(R)-BINAP,反应能取得72%的收率和74:26的er值。于是,作者考察了(R)-BINAP (7a)、(R)-BINAP(O) (7b)和(R)-BINAPO (3a)的反应效果,结果表明只有双氧化膦3a有活性。此外,作者也筛选了其它种类的配体(如氮齿配体、三价膦配体、氨基酸类配体等),但是都没有监测到产物。
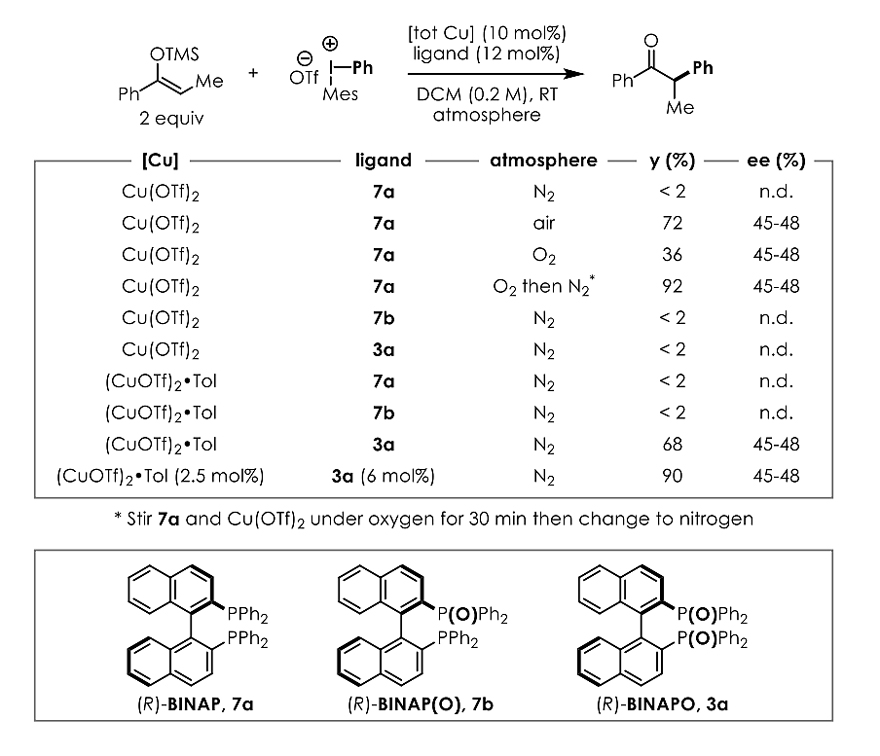
图2. 配体考察。图片来源:J. Am. Chem. Soc.
紧接着,作者开始对双氧化膦类配体3进行了筛选(图3A),结果显示GARPHOSO (3i−3m) 和 SEGPHOSO (3n−3p) 的效果最好,其中DMM-GARPHOSO (3l) 能取得86:14的er值。当采用缺电子配体 (3m) 时,反应活性较低,增加芳基的位阻也会导致对映选择性急剧下降 (3p)。尽管3a-3u的对映选择性控制不大理想,但是作者认为这组数据可以用于相关性分析,不仅能借助理论计算确认最佳的配体结构,同时还可以减轻配体合成的工作量。为此,作者选择M06-2X/6-31G(d)为算法,采用不对称P=O键的伸缩频率 (υPOas) 来标记配体的电性。在计算过程中,作者先剔除了一些干扰数据,即由大位阻和特殊结构配体产生的实验数据(如3e−3h、3p、3s和3t),再得到了反应的对映选择性(以ΔΔG⧧ (kcal/mol) 来表示)与υPOas的关系(图3B),这也暗示了配体的电子效应对反应过渡态的影响。参考Hammett σ参数的相关性以及对3i-3l的对映选择性数据的比较,3v被认为是一个有希望的配体。另外,从图3B的相关性关系中预测3v的表现中规中矩(理论猜测er值: 80:20),而3x是最佳的候选配体(理论猜测er值: 90:10)。因此,作者合成了配体3v、ent-3z和3x,结果显示它们的实验数据与理论计算值十分吻合,比如当3x为配体时,反应能以94:6的er值和58%的收率得到6a。

图3. 配体效应和理论计算。图片来源:J. Am. Chem. Soc.
在得到最优手性配体(3x)后,作者对反应的底物范围进行了考察(图4)。无论烯醇硅醚的间位还是对位带有给电子基,都能顺利地参与反应,以良好的收率和优异的对映选择性(er ≥ 95:5)得到目标产物 (6b−6e、6h、6j)。尽管底物6i的反应活性不错,但是可能受邻位甲氧基的影响,反应的对映选择性稍低 (er值:83:17)。当烯醇硅醚被吸电子基团取代时(即亲核性降低),反应活性会有所下降(6f、6g)。但是换用ent-3z作配体后,6f的活性有所提高,6g的对映选择性也有所改善,而且随着反应时间延长,6g的收率变高且ee值不受影响。当烯醇硅醚的α-位被乙基取代时(6k、6l),也能以优秀的对映选择性(er值分别为96.5:3.5 和97.5:2.5)完成转化。但是当其α-位被苄基(6m)或异丙基(6n)取代时,收率有所下降甚至不反应。
此外,作者也考察了环状酮的反应效果,发现四氢萘酮类底物(6z)能以不错的对映选择性(94:6 er值)参与反应,尽管收率较低;相反,4aa的活性尚可,但是选择性较差。值得注意的是,该反应也可实现链状二烷基酮 (6ac-6af) 的α-芳基化修饰,这在不对称α-芳基化反应中是前所未有的。不仅如此,酯也能兼容该反应,例如手性丙酸甲酯 (ent-6ab) 在ent-3z的催化下能以50%的收率和90:10 er值实现转化。之后,作者还考察了二芳基碘鎓盐5的电子效应和位阻效应。不管是富电子还是缺电子的芳基碘鎓盐 (6o-6x) 都能以良好的收率和不错的对映选择性参与反应,而芳基邻位取代的碘鎓盐则不能顺利地完成转化 (6y)。最后,作者通过和文献比对产物的旋光,确认了产物的绝对构型。需要指出的是,先前有关这类链状α-芳基酮结构的合成方法只有三种:α-卤代酮参与的Kumada反应、苄基自由基的光催化酰化反应以及多步合成法。
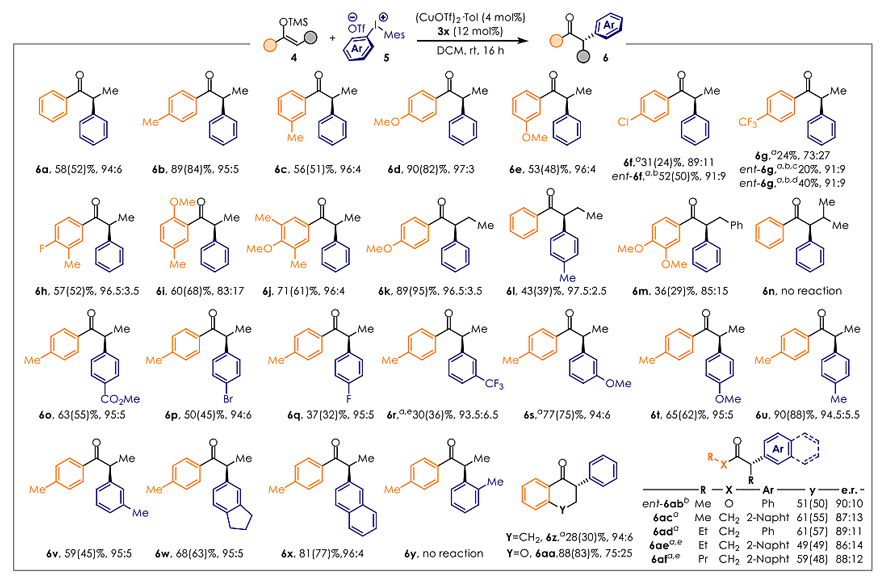
图4. 底物研究。图片来源:J. Am. Chem. Soc.
通常情况下,氧化膦和过渡金属的配位相对不稳定,容易解离,所以它们更多的时候被当作Lewis碱使用。此外,氧化膦在二氯甲烷中能和高价碘络合(络合常数K ≃50-200 M-1)。因此,关于氧化膦在该反应中到底扮演何种角色有两种猜测。一是作为配体,与金属铜配位(图5B);二是作为活化试剂,与高价碘作用生成高价Lewis酸碱复合物(图5A)。为了弄清楚氧化膦的作用,作者进行了初始速率动力学分析,发现氧化膦3a的浓度和1/kobs(反应速率常数的倒数)呈线性相关。该动力学阶数是-1,说明3a很可能先参与到一个预平衡中,再经历解离才开始完成目标反应。若3a直接与碘鎓盐形成复合物,那么便已具有催化活性,这与动力学数据不符 (图5A)。若3a先与铜盐生成二配位的非活性物种[Cu(3a)2Xn],则需要先解离一分子3a才能得到活性物种[Cu(3a)Xn] (图5B)。这个解释与动力学数据相符。当然,作者也指出这并不能排除体系中生成了Lewis酸碱复合物的可能性。
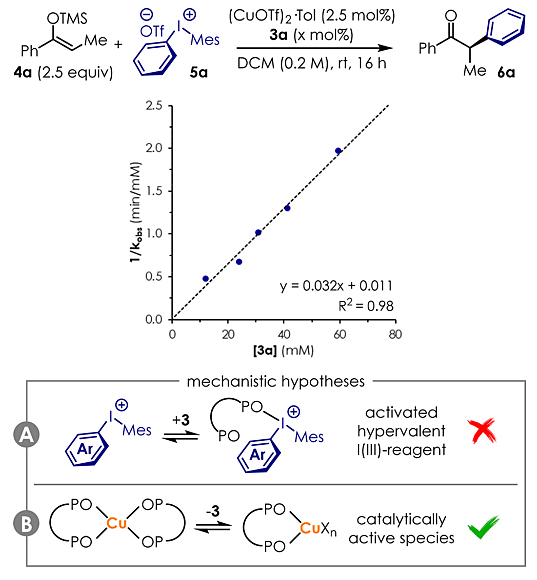
图5. 机理研究。 图片来源:J. Am. Chem. Soc.
总结
Manuel Orlandi教授研究团队发展了铜催化的烯醇硅醚和碘鎓盐的不对称α-芳基化反应,为手性α-芳基链状酮的合成提供了一个新的方法,又为手性双膦氧化物在过渡金属不对称催化中的应用增加了一个有参考价值的案例。这项工作在一定程度上弥补了之前发展的α-芳基化反应的不足,同时作者通过计算研究确立最优配体从而减轻工作量也是一个值得借鉴的地方。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective α-Arylation of Ketones via a Novel Cu(I)− Bis(phosphine) Dioxide Catalytic System
Margarita Escudero-Casao, Giulia Licini, Manuel Orlandi
J. Am. Chem. Soc., 2021, 143, 3289–3294, DOI: 10.1021/jacs.0c13236
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!




























 京公网安备 11010802027423号
京公网安备 11010802027423号