吡啶氢化也可玩出新花样,不对称合成δ-内酰胺
金属催化的氢化反应是一种简单、有效的增加分子复杂性的方法。例如,简单易得的N-杂芳烃(如吡啶)的氢化反应是制备饱和氮杂环的有效方法。但是,目前的加氢策略仅限于构建新的C-H键和N-H键;并且通常需要额外的合成操作以引入其它的官能团。如图1所示,在芳烃的氢化过程中分子氢的逐步加成会产生双键残留的活性中间体,从原则上来讲,后者提供了进一步官能团化的可能性。然而,尽管目前已经实现了某些底物(如苯、苯酚)的部分氢化,但在芳烃氢化过程中利用不饱和中间体来构建C-X键却寥寥无几。
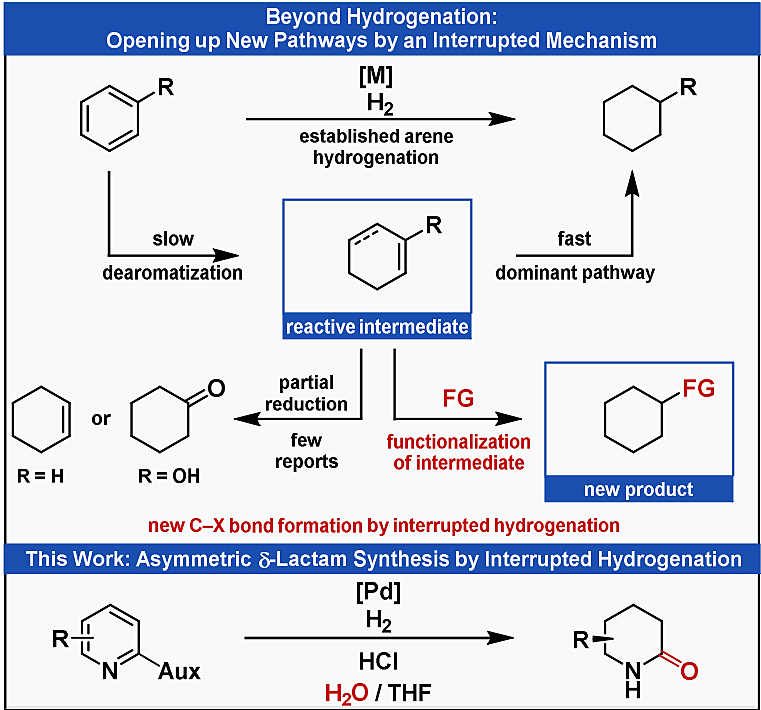
图1. 研究背景及本文的工作。图片来源:Angew. Chem. Int. Ed.
2019年,Donohoe等人在吡啶鎓盐转移氢化过程中实现了C-H键和C-C键形成的开创性组合(Nat. Chem., 2019, 11, 242,点击阅读详细),即使用铱催化进行氢转移,然后进行羟甲基化,最终合成了带有保护基的四氢吡啶。在此基础上,德国明斯特大学的Frank Glorius教授(点击查看介绍)课题组设想能否利用不饱和中间体来构建C-X键?近日,他们报道了钯催化的噁唑烷酮取代的吡啶和水的不对称氢化反应,即通过不饱和中间体的亲核取代而中断的吡啶氢化反应。该方法不仅能够在水存在下进行,还合成了一系列有价值的δ-内酰胺。相关成果发表在Angew. Chem. Int. Ed. 上。
内酰胺(如2-哌啶酮)是一种重要的合成砌块,广泛存在于各种天然产物和药物分子中。尽管化学家对该部分很感兴趣,但要想合成手性δ-内酰胺仍颇具挑战。于是,作者设想通过金属催化的氢化反应来解决该问题。然而,由于酰胺共振的阻碍,无法直接对吡啶酮前体进行不对称氢化。为此,作者选择噁唑烷酮取代的吡啶(可从廉价易得的2-卤代吡啶一步制得)为底物,并且噁唑烷酮在反应中被裂解,因此是可完全回收的无痕手性助剂。
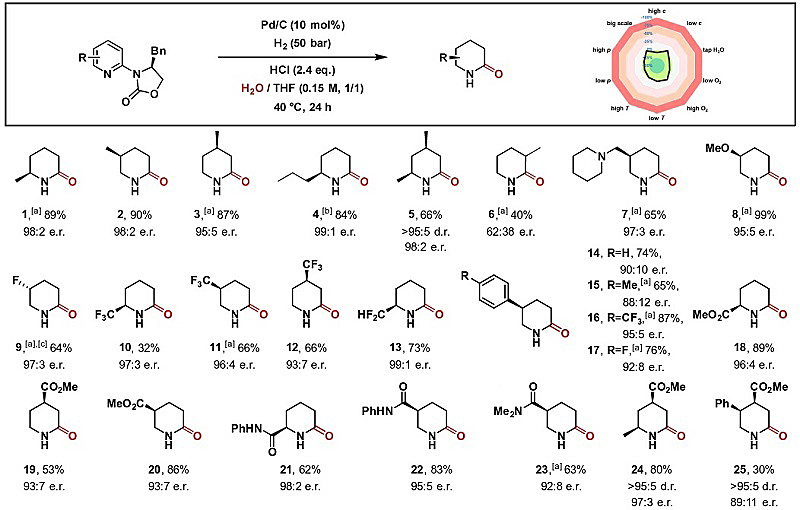
图2. 底物扩展。图片来源:Angew. Chem. Int. Ed.
在此基础上,作者详细地研究了反应参数的影响。结果显示像盐酸这样的强Brønsted酸是必不可少的,使用弱Brønsted酸(如甲酸)会形成哌啶产物。此外,作者还测试了不同的溶剂,THF和H2O的混合溶剂效果最好。催化剂的性质对反应结果也是至关重要的。尽管各种Pd催化剂都能以高收率和对映选择性得到所需的δ-内酰胺,但其它催化剂(如PtO2、Ru/C或Rh/C)的收率较低或没有。各种噁唑烷酮都可提供高对映体比率的产物,而苄基取代基可提供最佳结果。将氢气压力降低至25 bar会导致对映体比率降低。
在优化条件下,作者研究了该反应的底物范围(图2),合成了一系列烷基化的δ-内酰胺(1-4),不仅收率高,而且对映体比率极佳。此外,该方法还能以高度选择性的方式构建多个手性中心,以66%的收率、98:2的对映体比率分离出单一的非对映异构体——二甲基化内酰胺5,也可耐受其他官能团,例如碱性氮杂环化合物(7)、烷基醚(8)、氟原子(9)、三氟甲基(10-12)以及二氟甲基(13),产率中等到优异。有趣的是,苯基取代的吡啶会选择性地在吡啶核上进行氢化,以较好的收率得到各种取代的苯基哌啶酮(14-17)。此外,该反应能以中等至优良的收率、较高的对映体比率制备带有羰基官能团的δ-内酰胺,如酯和酰胺(18-23)。还可以高选择性地合成二取代的δ-内酰胺(24和25),分别以97:3和89:11的对映体比例观察到一种非对映异构体。不幸的是,3-位取代的吡啶不仅收率较低,还得到了几乎外消旋的混合物(6)。作者还通过X-射线单晶分析确定了δ-内酰胺1和10的绝对构型,并且与之前的观察结果一致(图3)。最后,基于Horiuti-Polanyi非均相加氢机理,他们确认了4-位和5-位带有取代基的产物的绝对构型。与该模型一致,氘代实验证实了仅在吡啶的一个非对映异构面上添加氘。
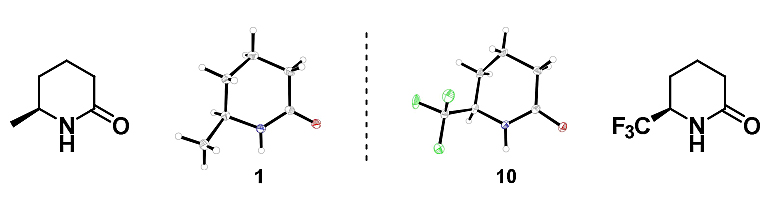
图3. δ-内酰胺1和10的单晶。图片来源:Angew. Chem. Int. Ed.
随后,作者研究了该过程的可扩展性以及回收辅基的可能性。如图4a所示,氢化反应能以2 g规模进行,且收率和对映体比例没有明显损失,最终以78%的收率和97:3的对映体比例获得内酰胺ent-4,并以92%的收率和> 99:1 的e.r. 值回收了噁唑烷酮26,从而证实了其良好的可回收性。此外,作者还将δ-内酰胺ent-4在盐酸中加热24 h后用甲醇处理,以99%的收率和97:3 的e.r. 值得到δ-氨基酸甲酯27(图4b)。
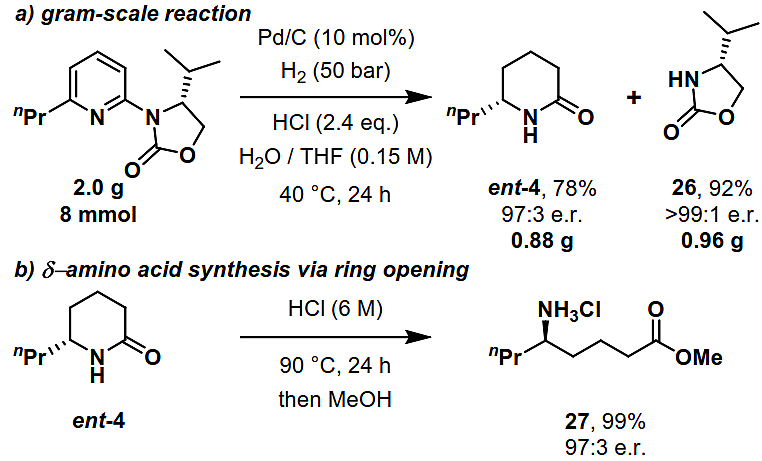
图4. 克级规模反应及开环反应。图片来源:Angew. Chem. Int. Ed.
最后,作者还研究了反应机理。为了鉴定潜在的中间体,作者在2h后停止反应,并通过GC-MS检测到保留一个双键的中间体的分子量(图5a)。尽管不饱和中间体在芳烃氢化过程中的寿命很短,并且迅速被进一步氢化,但亚胺28还能以5%的分离产率得到(图5b)。在不存在Pd催化剂和H2的情况下,用盐酸将亚胺28在水/THF中进行处理,几乎定量的转化成δ-内酰胺产物(图5c)。这些结果表明亚胺28是该反应的中间物种,并且可以与水进行亲核取代。值得一提的是,在该反应的六个潜在中间体中,只有亚胺28适合于水解以生成所需的2-哌啶酮。基于这些实验,作者提出了以下可能的反应机理(图5d):在Brønsted酸作用下,噁唑烷酮取代的吡啶上的碱性氮原子被质子化,并通过与噁唑烷酮的氢键作用形成稳定的构象异构体。由于该刚性构象的噁唑烷酮取代基的空间排斥作用,吡啶的无阻碍面的非对映选择性氢化继续进行以建立新的立体中心。在加入两当量的H2后,形成噁唑烷酮取代的亚胺I。与经典的芳烃氢化过程相比,该中间体不会再进行另一次催化还原反应(参见产物III),但会与水发生亲核取代反应,并在取代过程中噁唑烷酮被释放,因此用作可回收的无痕助剂。所得的亚胺鎓II快速互变异构,以产生最终的δ-内酰胺产物。
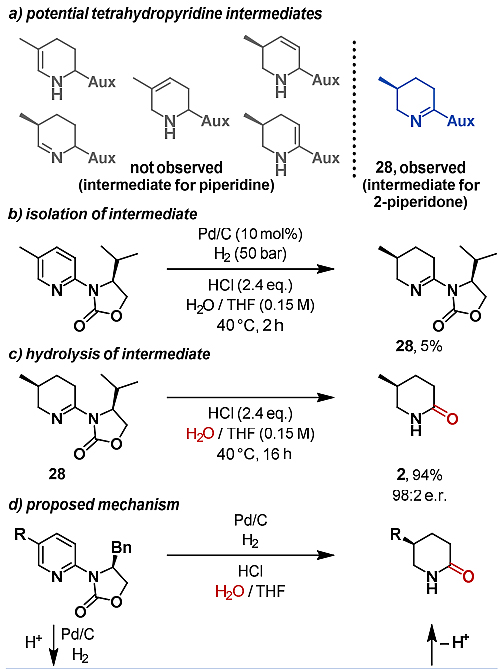

图5. 机理研究及可能的机理。图片来源:Angew. Chem. Int. Ed.
总结
Frank Glorius教授课题组报道了钯催化的噁唑烷酮取代的吡啶的不对称氢化反应,即被亲核取代中断的杂芳烃氢化反应。该反应可通过应用噁唑烷酮作为无痕手性助剂来制备一系列手性δ-内酰胺,并且产率高、对映选择性好。利用芳烃加氢过程中的不饱和中间体是一个尚待研究的领域,它克服了仅形成C-H键和N-H键的固有局限性。该反应仅一步就大大增加了分子的复杂性,具有巨大的应用潜力。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Interrupted Pyridine Hydrogenation: Asymmetric Synthesis of δ-Lactams
Tobias Wagener, Lukas Lückemeier, Constantin G. Daniliuc, Frank Glorius
Angew. Chem. Int. Ed., 2021, DOI: 10.1002/anie.202016771
导师介绍
Frank Glorius
https://www.x-mol.com/university/faculty/46677
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号