清华大学林金明教授课题组近年来重要工作概览
林金明,清华大学化学系教授,博士生导师,1984年福州大学本科毕业,1992-2002年在日本留学和工作,1997年3月获得日本东京都立大学工学博士学位,同年留校任教。2000年入选中国科学院“百人计划”,受聘中国科学院生态环境研究中心研究员,博士生导师。2001年获得国家杰出青年科学基金,2004年入选清华大学“百人引进”,2008年受聘教育部长江学者特聘教授,2014年入选英国皇家化学会会士。目前主要从事微流控细胞分析、空气负离子制备与应用、化学发光免疫分析的研究。在Angew. Chem.、Adv. Sci.、Chem. Sci.、Anal. Chem.、J. Chromatogr. A等期刊发表研究论文400余篇,授权专利30项,并在专利基础上研制成功多款仪器设备,得到普及推广。目前兼任中国化学会监事会监事、分析化学专业委员会副主任、质谱分析专业委员会副主任,中国药学会药物分析专业委员会副主任委员,中国分析测试协会常务理事等多种学术委员会委员。Trends in Analytical Chemistry 责任编辑,Journal of Advanced Research、Luminescence、J. Pharm. Anal.、Chinese Chemical Letters、《质谱学报》和《分析试验室》等期刊副主编。《分析化学》、《药物分析杂志》、Sci. Rep.、Talanta、Anal. Chim. Acta、Science China Chemistry等多种国内外期刊编委。

林金明教授。图片来源:清华大学化学系官网
微流控单细胞分析
细胞是生命组成结构的基本单位,同时细胞研究是生命科学的根基。近年来,单细胞分析逐渐成为一个热门的研究领域,其揭示在形态、功能、组成和遗传性能上看似相同的细胞的异质性。得益于微流控技术的发展,单细胞分析在各个领域中得到了空前的进步和发展。单细胞分析技术的进步极大了推进了单细胞生物学,为生命科学研究开辟了新的研究领域。然而,如何精准研究单个细胞,特别是细胞与基底间的关系,是当前单细胞研究面临的重大挑战。
清华大学化学系林金明教授课题组在国家自然科学基金仪器专项“细胞微环境模拟与分析专用微流控芯片装置的研制”(项目编号:21727814)支持下,在课题组专利技术的基础上,成功研制了如图1所示的多通道微流控芯片质谱联用细胞分析系统,并由岛津公司实现产业化,成为商品化的“细胞微流控芯片质谱联用系统(Shimadzu Cellent CM-CM)”,提供用户使用,获得很好的评价。为了推广仪器的应用领域,先后在全国不同城市举办了9期微流控芯片质谱联用细胞分析讲习会,并分别于2018年和2019年9月召开了两届微/纳流控细胞分析学术报告会,取得很好的效果。2018和2019年先后在Springer出版《Cell Analysis on Microfluidics》和《Microfluidics for Single-Cell Analysis》,在科学出版社出版《微流控芯片细胞分析》和在Trends in Analytical Chemistry出版Micro/Nanofluidics for Cell Analysis专辑(2019年第117卷)。
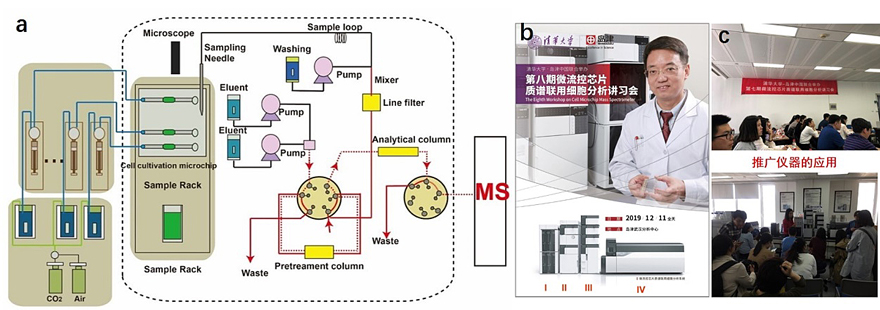
图1. 多通道微流控芯片质谱联用细胞分析系统。a)仪器原理图;b)仪器整体结构与推广;c)技术推广培训现场
在微流控芯片质谱联用仪器研制成功的基础上,林金明教授课题组进一步巧妙地利用了微流体的层流效应、流体力学以及表面张力限制等基本原理,提出了开放微流体细胞分析技术,得到国家重点研发计划(项目编号:2017YFC0906803)和国家自然科学基金重点项目(项目编号:22034005)的支持,系统地开展微流控单细胞分析方法的研究。成功地实现了基于开放微流体的单细胞提取器能够实现单细胞提取、单细胞粘附分析、细胞-细胞间粘附的分析。进一步地,该课题组还研究了癌症转移中循环肿瘤细胞与血管内皮的粘附性,为揭示肿瘤细胞转移提供了重要信息。通过控制开放微流体,实现微区反应的控制,设计研制了一种适合于活体单细胞损伤与修复研究的“开放式”微流控芯片。研究活体细胞的液体分割和流体驱动的相关机理,发展一种能够对单细胞进行局部刺激的微流控技术,并依靠该技术探究单细胞自我修复及调整能力。通过裂解液溶解细胞的局部区域形成结构性创口,观测细胞的伤口修复和缺失部位的再生,取得了初步的研究成果。
本文将重点介绍近年林金明教授课题组的一些有代表性的工作。
(一)基于开放式微流控探针的亚细胞原位自由基刺激
开放式微流控是近年来新兴起的一类技术,所用到的微流控探针能够操控其底部开放空间内的流体流动。由于流动限制效应,从探针所流出的液体能够在散开之前被完全抽回去,因此所注射的溶液能够在开放空间内形成封闭的分布区域,该区域通常为几十到一百微米,与贴壁细胞尺度相当,进而便于实现单细胞操作。近年来,林金明教授课题组已经基于该方法实现了单细胞-基质(Angew. Chem. Int. Ed., 2018, 57, 236-240)及单细胞-细胞层之间(Chem. Sci., 2018, 9, 7694–7699)的粘附测量;探究了基质材料(Anal. Chem., 2018, 90, 9637-9643)、长期的流体剪切力(ACS Sens., 2019, 4, 1710-1715)、药物(Sci. China. Chem., 2020, 63, 865–870)对于细胞粘附行为的影响;实现了单细胞的切割和局部染色,并以此探究了单细胞的自修复行为(Anal. Chem., 2019, 91, 1644-1650)和线粒体传输速率(Chem. Sci., 2019, 10, 2081-2087)。最近,该课题组又利用该类方法进行了原位的化学反应,通过微米级别区域内实时稳定产生的自由基实现了亚细胞的刺激和膜标记(Angew. Chem. Int. Ed., 2021, DOI: 10.1002/anie.202016171)。
随着研究的深入,人们已经发现即使是同一个细胞,其不同部位也存在着较大的差异性。就如同我们个人身上的不同部位受到刺激会产生不同的感觉,对于细胞不同部位的刺激也可能会引发细胞不同的响应效果,这有助于人们更加深入地了解细胞的行为性质,因此研发用于亚细胞刺激的高精度方法格外重要。
作为一类高活性物种,自由基与多种生理及病理过程密切相关。但由于其寿命极短,人们不可能预先配置自由基溶液。通过加反应物的方式原位产生自由基虽然可行,但自由基浓度会快速变化,直至其完全淬灭,不能用来对细胞施加稳定的刺激。
为解决这一难题,林金明教授课题组发展了一种三通道的微流控探针方法。如图2所示,两侧注入不同反应体系A、B,这两股溶液会在芯片底部的开放空间中形成稳定分布。他们会在中间通道下方空间的微米级别区域内相遇并反应,进而原位生成高活性的自由基刺激细胞。
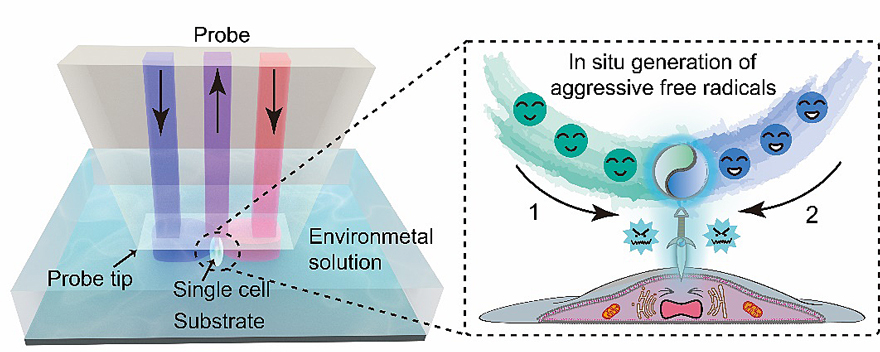
图2. 原理图:利用三通道的微流控探针在细胞上方微区进行原位反应,利用产生的自由基刺激细胞。图片来源:Angew. Chem. Int. Ed.
在该连续流微流控系统中,由于液体在不断流动,混合物体系的反应时间(t)与空间位置(p)形成了对应关系t = g(p),因此静态体系中的物质浓度(c)与时间(t)的动力学关系c = f(t)在流动体系内被转换为了浓度(c)与位置(p)的关系c = f(g(p))。后者排除了时间因素的干扰,因此物质浓度只与空间位置有关,对于每个位置来说物质浓度在理论上都是稳定不变的。这意味着自由基虽然寿命短,但它仍能够在微流控系统中以稳定的浓度空间分布永久存在。
作者通过流体力学数值模拟和实验优化了相关参数,成功实现了亚细胞水平的自由基刺激,并利用荧光标记的酪酰胺自由基与膜蛋白酪氨酸残基的共价连接反应实现了定点的细胞膜标记(图3)。此外,作者也观察到了被标记的细胞膜在细胞上的相对位移,这初步展示了该方法在膜追踪领域的应用潜力。
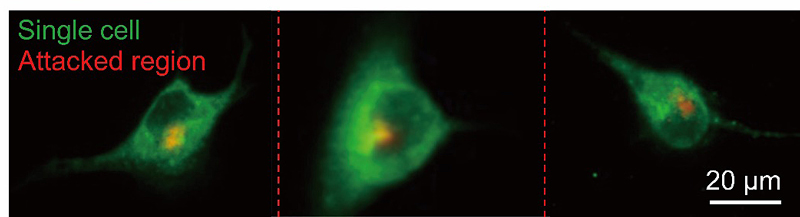
图3. 利用红色荧光标记的酪酰胺自由基标记膜,从而显示刺激区域。图片来源:Angew. Chem. Int. Ed.
该方法具有一定的普适性,可以预见的两个发展方向是:利用其它反应物体系产生不同自由基(•OH, O2-•, NO•, ROO•, •NOO- 等),用于亚细胞刺激,从而研究细胞行为;利用细胞上定点染色的方式实现目标膜区域的标记追踪,亦可在细胞上写字或作画,实现个性化细胞标记或艺术创作。
(二)利用液晶弹性体微球实时监测细胞膜表面的过氧化氢
利用液晶微球传感来实现单细胞分析是近年来林金明教授课题组的另一个重要方向。具有良好生物相容性的聚合物封装的液晶微滴,可固定在细胞膜表面,高灵敏度高选择性地实时监测细胞/单细胞释放的目标分子或者离子。传感所用的液晶核心为掺杂了4-戊基联苯-4'-羧酸(PBA)的E7,该有机弱酸能够因为周围氢离子浓度的降低而产生电荷差异(低PH弱酸不带电,高PH弱酸羧基解离形成负离子),这会导致液晶微球整体构型从辐射型(Radial)变为双极型(Bipolar),这种构型变化能够在偏光显微镜下进行实时观察,因此该方法能够实时原位测量周围的氢离子浓度。通过将其他待测物质转化为液晶附近pH的方式,便可以利用该方法进行不同的细胞分析,目前已实时测量的细胞表面释放的NH3(Adv. Sci., 2019, 6, 1900778)和H2O2(Angew. Chem. Int. Ed., 2020, 59, 9282–9287)。
如图4所示,该液晶弹性体微球上修饰了辣根过氧化物酶(HRP),它能够催化H2O2分解,同时产生OH-。液晶内部由于过氧化氢分解而产生OH-能够在逃逸出微球之前便与周围的PBA原位反应,从而导致PBA电荷变化,继而引起液晶构象改变。液晶构象改变的速度可以半定量地反映其附近OH-的浓度,从而推算H2O2的浓度,实现细胞表面H2O2的检测。

图4. 利用液晶弹性体微球实时监测细胞表面H2O2。图片来源:Angew. Chem. Int. Ed.
(三)利用3D微流控可控地合成多腔室凝胶颗粒
基于微流控液滴和凝胶微球的细胞研究一直是林金明教授课题组的重点方向(Small, 2019, 16, 1903402; Anal. Chem., 2019, 91, 12283-12289; Chinese Chem. Lett., 2020, 31, 451–454)。合成多腔室的凝胶微球对于研究各向异性颗粒的性质及细胞间通讯等课题有着重大的意义,然而主流的方法所制作的凝胶微球所包含的腔室数目有限(通常小于10个)。为解决这一难题,该课题组于2020年研发了一种3D微流控方法,轻松地合成了包含20个腔室的凝胶微球,理论上腔室数可以无限大(Angew. Chem. Int. Ed., 2020, 59, 2225-2229)。如图5所示,作者利用微流控芯片的方式将多股流体汇聚到中心点上,然后从芯片中心的下方垂直引出一条毛细管通道。由于层流效应,竖直毛细通道内多股流体中的粒子(细胞、磁珠等)不会很快发生混合。在颗粒混合之前,利用侧向注入的油相流体切割水相液体,进而形成液滴。同时,油相的醋酸渗透进液滴,引发海藻酸钙的快速交联,实现液滴的凝胶化,进而将粒子限制在原来的位置,将多种不同粒子包裹在同一凝胶颗粒的不同位置。
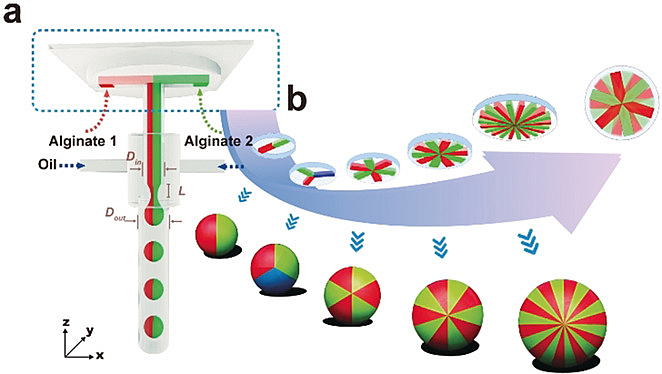
图5. 利用3D微流控制造多腔室凝胶颗粒。图片来源:Angew. Chem. Int. Ed.
该方法可以将不同细胞和颗粒(磁性、荧光)等包在一个凝胶颗粒中,因而在细胞共培养和原位检测等方面有很好的应用前景。
导师介绍
林金明
http://www.linlab-tsinghua-edu.org/fblw/cid/44.html
https://www.x-mol.com/groups/Linlab
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



























 京公网安备 11010802027423号
京公网安备 11010802027423号